|
血が赤いのは、血液が酸素や炭酸ガスを運搬するという機能と関係があります。
トマトジュースも赤いですが、血液もトマトジュースと同じでしょうか?
血液が赤い理由
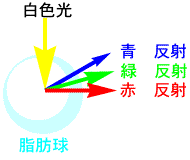
血液の赤いのは赤血球が含まれているからです。ミルクや豆乳の成分は血液と似ていると述べました。ミルクや豆腐が白いのは、脂肪が球状で可視光の波長よりも大きいので、全ての波長の光が反射して白く見えるのでした。
赤血球も可視光線の波長よりも大きな粒子ですが、赤以外の青や緑の光を吸収して赤の光を反射するので赤く見えるのです。赤の光だけ反射するのは、トマトやリンゴが赤く見えるのと同じ理由です。トマトジュースが赤いのは、リコピンを含んだトマトの赤い粒があるからで、血液が赤いのと似ています。 |
 |
 |
 |
|
ミルクや豆乳
(脂肪球で全反射)
|
血液(赤血球で赤反射)
|
血液の成分
血液を採りだし、凝固抑制剤を加えて遠心分離(洗濯機の脱水機のようなもの)すると、赤血球は重いので底に沈殿し、その上に白血球が膜(バフィーコート
buffy coat)を形成し、上澄みが血漿となります。血液から赤い赤血球を取ると、黄色い液体である血漿が得られます。この中にタンパク質が含まれています。ミルクを遠心分離すると脂肪球が沈殿してバターになりますが、血液の場合は赤血球が沈殿してきます。
赤血球の割合は血球容量(hematocrit)と呼ばれ、普通45%で、値がこれより小さいと貧血の可能性があります。血漿は淡い黄色のpH
7.4の液体で、水分は91%で、タンパク質6〜8%、無機の塩0.9%、脂肪0.6%、グルコース0.1%が含まれています。
赤血球
赤血球(Red blood cell or erythrocytes)は球ではなく、穴のあいていないドーナッツのような形をしています。直径は8μmで、厚さは約2μmですから、可視光線の波長よりも大きいです。
赤血球にはヘモグロビンがいっぱい詰まっています(乾燥重量で90%)。生きた細胞には核があって、その中に遺伝子DNAが入っているのですが、人間の赤血球には核が無く、そのスペースをヘモグロビンで埋めて、酸素を有効に運搬できるようになっています。赤血球は骨髄で作られますが、途中までは核が存在しますが、できあがった赤血球には核が無くなっています。 |
 |
生きている細胞は細胞分裂を起こし、新しい子孫の細胞を作っていきます。赤血球は核が無いので子孫を作ることはできません。生きていなくても赤血球は酸素を運ぶ活性を持っています。骨髄で作られた赤血球は約120日間、その活性が保たれます。生物に含まれ、生きてはいない(核がない)が活性を持っているものには酵素があります。酵素は細胞ではなくタンパク質分子ですが、活性を持っています。生きてはいないが活性を持っているものにはBSE(狂牛病)を起こすプリオンタンパク質があります。
赤血球の膜にはマイナスの荷電を持ったノイラミン酸が含まれているので、静電反発があるので、凝集することなく安定に存在します。しかし、傷をしてでてきた血液は凝固しますし、異なる血液型の血液を混合すると凝集します。
血小板(platelets or thrombocytes)
血液の約1%で、血液1mm3に約14〜36万個。大きさは直径約2μmで円盤状です。怪我などで血管が損傷を受けると、真っ先にその部分に集中して粘着し、互いにくっつきあって大きくなり、傷口を塞ぎます。さらに血漿中のフィブリノゲンという物質が働いて、血液の固まりをつくりあげ、止血する働きをします。
白血球(white blood cells or leukocytes)
血液成分の約3%で、白血球(white blood cells or leukocytes)細胞には5種類があります。
3種類の顆粒球(granulocyte)・・生体防御系に関与します。
好中球(neutrophils)55%
好酸球(eosinophils) 3%
好塩基球(basophils)0.3%
2種類の顆粒を細胞質に含まない白血球
リンパ球(lymphocytes)・・免疫機能に関与。細胞表面にヒト白血球抗原(HLA)が存在する。
単球(monocytes)・・免疫能に関与。
白血球は核が存在する生きた細胞ですが、ヘモグロビンは含まれていないので、ミルクの脂肪球と同じく全ての光を反射して、白く見えます。
血漿
血液成分の約55%を占めていますが、そのうち91%は水分で、固形成分は9%です。固形成分の主なものは、アルブミン、グロブリン、血液凝固因子などのタンパク質です。この他、無機塩類、糖質、脂質を含みます。
無機の塩類は0.9%で、生理食塩水は0.9%の食塩水です。
血漿には大きな粒子は含まれず、分子レベルのものばかりですから透明です(少し黄色を帯びていますが)。
組織呼吸の結果生成された炭酸ガスを肺へ運び、空気中へ放出させます。また栄養分を体内の各所へ運び、そこで生じた代謝老廃物を腎臓から排出したり、血圧の保持に役立っています。また、血漿に含まれる抗体が病原菌に対抗する力を持っています。
赤血球が赤い理由
血液が赤いのは赤血球のためですが、赤血球が赤いのは中にヘモグロビンが含まれているからです。ヘモグロビンがなぜ赤いのかを見てみましょう。
ヘモグロビン
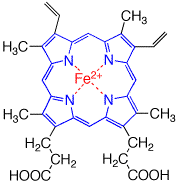
ヘモグロビン(hemoglobin)はヘム鉄錯体(heme)とグロビン(globin)というタンパク質からできています。
グロビンは透明ですが、ヘムは赤色であるので、ヘモグロビンは赤色です。血液が赤い理由は鉄錯体の色だったのです。赤血球の65%は水であり、34%がヘモグロビンです。 ヘモグロビンの分子は,α・βの2種類2個ずつ(4量体)からなっています(上のモデルでは、青、紫、緑、赤の四つのヘモグロビン分子を示している)。
その各々のヘムの部分のFeが酸素と結合することができます。
ヘモグロビンのサブユニット(1量体)は,筋肉中に存在するミオグロビンによく似た構造をもっています。
赤血球は約120日で分解されますが、鉄イオンは再利用され、新しいヘムを作るのに使われます。
ヘム
鉄ーポルフィリン錯体
ヘムはポルフィリンが配位した鉄錯体です。人間以外にも魚や蛙などの脊椎動物の血は赤く、ヘモグロビンが含まれています。しかし、エビやタコのような無脊椎動物の血は赤くなく、青色をしています。これは、鉄錯体ではなく銅錯体のヘモシアニンだからです。
鉄−ポルフィリン錯体は安定で、古い血痕からもルミノール反応で検出することができます。
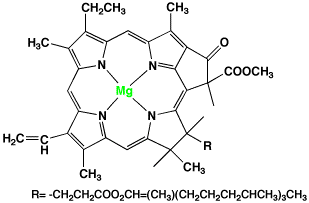
ポルフィリンのマグネシウム錯体はクロロフィルで緑色ですから、ポルフィリン金属錯体は中心の金属イオンの種類によって色が変わることが分かります。どうして金属イオンの種類によって色が違うのでしょうか?
 |
 |
|
ヘム
|
クロロフィル
|
ポルフィリン
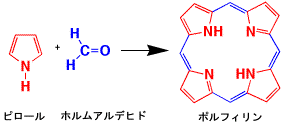
鉄(Fe)やマグネシウム(Mg)を取り囲んでいる基本骨格はポルフィリン環です。5員環のピロールとホルムアルデヒドが結合し、水が抜ける(縮合)とポルフィリン環ができます。環状にならずに伸びた鎖状になる可能性がありますので、Cuなどの金属をあらかじめ入れておいて、環状化合物のポルフィリンを作る鋳型反応を用います。中心の金属イオンは後で交換することが可能です。
|
|
|
ピロールとホルムアルデヒドからポルフィリン環の合成
|
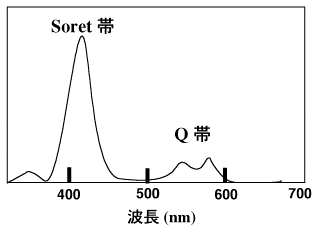
ポルフィリン環は平面になると共役系になるので、特徴的な吸収スペクトルになります(下の図)。400 nmの大きな吸収は発見者の名前を取って、Soret(ソーレー)吸収帯と呼びます。550
nm付近の吸収体はQ吸収帯と呼びます。ポルフィリン環が平面で共役系になると、吸光度が大きくなり大きな吸光係数を示すようになります。また、蛍光の強度も大きくなります。
 |
|
ポルフィリン環の吸収スペクトル
|
 |
|
ポルフィリン環分子モデルを横から見た図
|
金属イオンを含まないポルフィリン環は平面ですが、金属錯体では金属イオンの種類によって、ポルフィリン環は平面から歪んできます。すると、Soret吸収体の位置が変化し、高さ(吸光度)が変わってきます。上のスペクトルで、Soret帯が左(波長が短い青い方向)に移動すると、青の光を吸収するので、赤く見えてきます。Soret帯が右(波長が長い赤い方向)に移動すると、赤の光を吸収して青の光を反射するようになるので、青く見えるようになります。金属イオンによってポルフィリン環の歪みの程度が変わり、Soret帯の位置が変わり、吸収する光の波長が変わるので、色が変わるのです。
ポルフィリン環は平面ですが、酸性にしてNがプロトン化したり金属イオンが入るとポルフィリン環は歪んできます。すると、400
nm付近のSoret吸収体は移動し、色が変わります。銅、Cu(II)錯体ではSoret吸収体は434 nmで、青色になります。鉄、Fe(II)錯体では、吸収体が波長の短い395
nmに移動しますので、青が吸収されて赤色になります。
赤血球の機能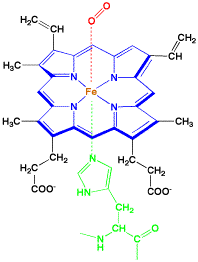
ヘモグロビンは酸素と結合して、肺から体内へと運搬します。また、体内で発生した二酸化炭素CO2を肺まで運び、酸素と交換します。このようにヘモグロビンが酸素と結合したり離れたりするのには、タンパク質であるグロビンが重要な働きをしているのです。鉄−ポルフィリン錯体であるヘムでは、鉄イオンの上側と下側が空いています。この下側にグロビンが結合し、酸素が上側に結合します。グロビンが下から押すと酸素が離れ、引っ張ると酸素が結合すると考えられます。
グロビンタンパク質の鉄に結合するアミノ酸単位はヒスチジンで、イミダゾール環の窒素がFeに配位します。
ヘムに酸素が結合したかどうかは、吸収スペクトルの550 nm付近のQ吸収体で分かります。酸素が結合すると山が2つ、酸素が離れると山が1つになります。心臓から出てきた血液(動脈)は赤いですが、心臓に戻ってくる血液(静脈)は青くなっています。それは、酸素が結合しているかどうかで、ヘモグロビンの構造が変わってくるためです。
ヘムのポルフィリン環は平面ですが、下からイミダゾールが配位すると、歪んできます。反対側から酸素が配位すると、再びポルフィリン環は水平になります。このようなポルフィリン環の構造が、血液の色の変化になります。
ポルフィリン錯体の利用
金属ポルフィリン錯体は安定で着色しているので、工業的に利用されています。
金属の比色定量試薬
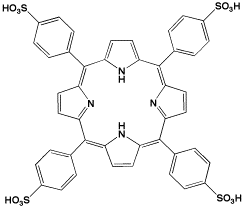
アルデヒド成分として、ホルムアルデヒドの代りにベンズアルデヒドを用いると、ベンゼン環が入ったテトラフェニルポルフィリンを合成することができ、ポルフィリン錯体の多くの研究が行われている。また、ベンゼン環にスルホン基を入れると水溶性になるので、金属イオンの比色検出に用いることができます。
TPPS
5,10,15,20-Tetraphenyl-21H,23H-porphinetetrasulfonic acid, disulfuric acid, tetrahydrate
水によく溶ける濃緑色〜緑青色の粉末。
pH6.5 では赤紫色 (Soret 帯吸収極大 λmax=413 nm, ε=5.1×105)、
pH 4 では緑色 (Soret 帯吸収極大λmax=434 nm, ε=5.0×105)となる。
酸性では Cu2+にほとんど特異的に強く発色するので、すぐれた比色試薬となり、アルカリ性では、
Cd, Pb などと発色してそれらの金属の定量試薬となります。
Cu(II)・・pH 4で、434 nm, ε4.8 x 104
Fe(II)・・pH 3.9-4.2で、395 nm, ε1.4 x 104
 機能性色素 機能性色素
フタロシアニン(phthalicyanine)は安定なポルフィリン環で、その銅錯体は青の顔料で、新幹線の青い塗料です。
また、様々な金属錯体が作れますので、複写機用光導電体、CD-R用の色素などのほか、有機ELや、色素増感太陽電池への応用が研究されています。
|