|
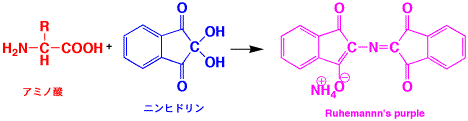
ニンヒドリン反応(Q 21)は指紋の検出にも用いられますが、タンパク質がどのようなアミノ酸でできているかを分析するアミノ酸分析が重要な用途です。
タンパク質の分析法
タンパク質はアミノ酸が連結(縮合)したものですから、加水分解によってばらばらにしてアミノ酸にし、ニンヒドリンで分析すると、タンパク質がどのようなアミノ酸からできているか(1次構造)を決めることができます。
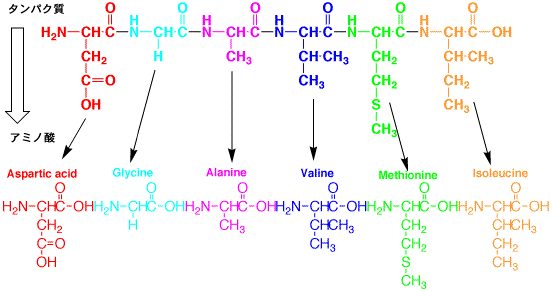 |
|
タンパク質を加水分解してアミノ酸に変え、ニンヒドリン反応を行う
|
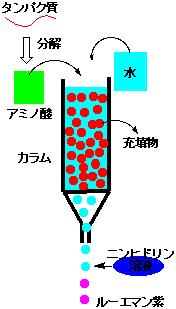
タンパク質の分析は次のような手順でおこないます。
(1)タンパク質の加水分解
(2)イオン交換カラムによるアミノ酸の分離
(3)ニンヒドリン反応による発色
(4)アミノ酸標品と比較して、アミノ酸の量を定量 |
 |
 |
|
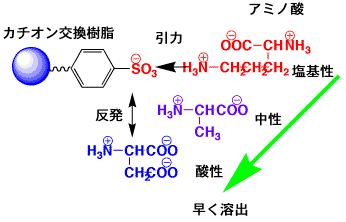
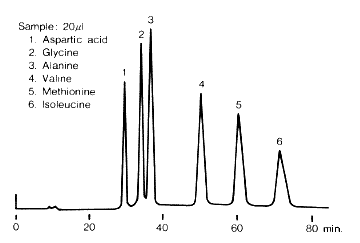
アミノ酸は酸性、中性、塩基性の順ででてくる
|
分析の流れ
|
加水分解
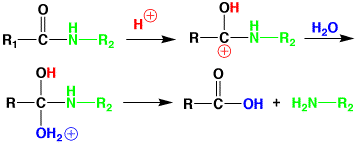
エステル(-COOR)は、酸(H+)でもアルカリ(OH-)でも加水分解ができます。しかし、タンパク質のアミド結合(-CO-NH-)は安定で、なかなか加水分解しません。タンパク質を分解するには、濃い塩酸(6N)を使い、110℃、24時間の反応で行います。濃塩酸は12N(規定)ですから、6Nの塩酸は、濃塩酸を半分に薄めたものです。水の沸点は100℃ですから、薄い塩酸を蒸留すると、まず水が出てきます。水が少なくなると沸点が高く110℃になり、6Nの塩酸が出てきます。これは、水と塩酸の共沸です。したがって、6Nの塩酸を使うと110℃で加水分解ができるのです。反応が終わったら、少し減圧で蒸留すると、塩酸を除くことができ、アミノ酸の塩酸塩ができます。
 |
|
アミドの酸による加水分解機構
|
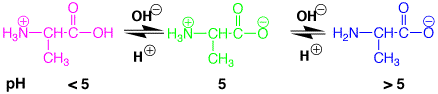
アミノ酸はアミノ基(-NH2)とカルボン酸(-COOH)があるので、pHにより変化します。
|
|
(1)酸性ではアミノ基がプロトン化して、NH3+になります。塩酸で加水分解したアミノ酸はこの状態になっています。
(2)苛性ソーダで中和していくと、カルボン酸のプロトンが取れてアニオンになります(-COOH → -COO-)。すると、自分自身の中にプラスとマイナスがありますので中和され、中性になって水に溶けなくなります。このようなpHが等電点(pI)です。
(3)さらに苛性ソーダを加えると、アミノ基のプロトンが取れて、再び水に溶けるようになります。 |
塩酸で加水分解した後、中和するとアミノ酸が沈澱で取れますが、アミノ酸の種類により等電点が違いますので、すべてのアミノ酸を取り出すには適していません。
カラム分離
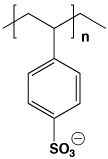
タンパク質の加水分解によりアミノ酸ができますが、そのアミノ酸を定量するには、分離する必要があります。アミノ酸の分離にはイオン交換クロマトグラフィーを用います。イオン交換樹脂を充填したカラムです。ここでは、強いカチオン交換カラム(-SO3Hを含む強酸性イオン交換樹脂、架橋ポリスチレンスルホン酸)を用います。
グルタミン酸やアスパラギン酸などは余分にカルボン酸を持っている酸性アミノ酸ですが、-COO-のマイナスがスルホン酸(-SO3-)のマイナスと静電反発するので、イオン交換樹脂に結合できずに早く出てきます。
グリシンやアラニンなどは、余分な-COOHや-NH2を含んでいない中性アミノ酸ですが、酸性アミノ酸の次に出てきます。中性のアミノ酸のうち、バリンやイソロイシンなどの大きなアルキル基を持ったものは水となじみが無い疎水性ですので、イオン交換樹脂のベンゼン環部分に付きやすい性質があり、グリシンやアラニンに比べて遅く出てきます。
リジンはアミノ基を含んだ塩基性アミノ酸ですが、-NH3+のカチオンがイオン交換樹脂のマイナスイオンに結合して、なかなか出てきません。イオン交換クロマトグラフィーでは緩衝液を流しているのですが、その濃度をだんだん濃くしていきます。すると、プラスとマイナスの静電引力が弱まり、塩基性アミノ酸も出てくるようになります。
 |
 |
|
カチオン交換クロマトグラフィー
|
ポリスチレン
スルホン酸
|
ニンヒドリン反応
アミノ酸が出てくるカラムの出口で、ニンヒドリンの溶液を加えます。この段階では着色してませんが、液を高温の層の中を通すと、紫色の色素に変わります。この溶液の色の濃さを、UVスペクトルで測定します。上のグラフは、吸光度の高さを、出てきた時間でプロットしてあります。あらかじめ、アミノ酸を使って何分で出てくるかを調べてあるので、どの山がどのアミノ酸かが分かりますから、山の高さからそれぞれのアミノ酸がどれだけあるかが分かります。
|
|
|
ニンヒドリン反応
|
ここで、アミノ酸の種類によってニンヒドリンと同じ程度に反応するかが問題になります。
次の表には、アミノ酸の溶出順序とニンヒドリンの発色率を示しました。ニンヒドリンによる発色率はアミノ酸によって同一ではないですが、プロリンとヒドロキシプロリン以外は発色率は同じであるとして計算します。プロリンとヒドロキシプロリンの場合は、440
nmで測定し、その価を3.8倍します。
アミノ酸の構造、溶出順序と発色率
発色率:緩衝液pH 2.2-5、加熱15分、吸光度測定570 nm(hydroxyprolineとprolineは440
nmで測定)、ロイシンを1.00としての比較(S. Moore, W. H. Stein, J. Biol. Chem., 211, 907 (1954).)
|
溶出順序
|
アミノ酸
|
英名
|
シンボル
|
略記
|
等電点
|
発色率
|
|
1
|
タウリン
|
taurine
|
|
|
|
0.88
|
|
|
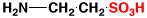
|
pK1= 1.5
pK2=8.74 |
|
2
|
アスパラギン酸
|
aspartic acid
|
D
|
Asp
|
2.8
|
0.94
|
|
酸性
アミノ酸
|
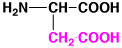
|
pKa:
1.88
3.65
9.60
|
|
3
|
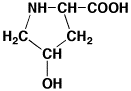
ヒドロキシプロリン
|
hydroxyproline
|
|
Hyp
|
|
0.077
|
|
|
|
pKa:
1.82
9.66
|
|
4
|
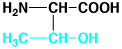
トレオニン
|
threonine
|
T
|
Thr
|
5.6
|
0.94
|
|
中性
アミノ酸
|
|
pKa:
2.09
9.10
|
|
5
|
セリン
|
serine
|
S
|
Ser
|
5.7
|
0.95
|
|
中性
アミノ酸
(含OH)
|
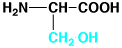
|
pKa:
2.19
9.21
|
|
6
|
グルタミン酸
|
glutamic acid
|
E
|
Glu
|
3.2
|
0.99
|
|
酸性
アミノ酸
|
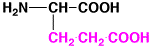
|
pKa:
2.19
4.25
9.67
|
|
7
|
アスパラギン
|
asparagine
|
N
|
Asn
|
5.4
|
0.95
|
|
中性
アミノ酸
|
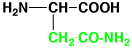
|
pKa:
2.02
8.80
|
|
8
|
グルタミン
|
glutamine
|
Q
|
Gln
|
5.7
|
0.99
|
|
中性
アミノ酸
|
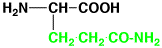
|
pKa:
2.17
9.13
|
|
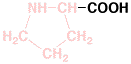
9
|
プロリン
|
proline
|
P
|
Pro
|
6.3
|
0.225
|
|
中性
アミノ酸
|
|
pKa:
1.95
10.64
|
|
10
|
グリシン
|
glycine
|
G
|
Gly
|
6.0
|
0.95
|
|
中性
アミノ酸
|
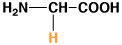
|
pKa:
2.35
9.78
|
|
11
|
アラニン
|
Alanine
|
A
|
Ala
|
6.0
|
0.97
|
|
中性
アミノ酸
|
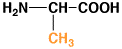
|
pKa
2.34
9.69
|
|
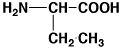
12
|
αアミノ酪酸
|
α-aminobutyric acid
|
|
|
|
1.02
|
|
|
|
pKa
2.29
9.83
|
|
13
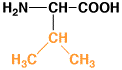
|
バリン
|
valine
|
V
|
Val
|
6.0
|
0.97
|
|
中性
アミノ酸
|
|
pKa:
2.32
9.62
|
|
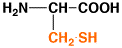
14
|
システイン
|
cysteine
|
C
|
Cys
|
5.0
|
0.55
|
|
中性
アミノ酸
|
|
pKa:
1.92
8.35
10.46
|
|
15
|
メチオニン
|
methionine
|
M
|
Met
|
5.7
|
1.02
|
|
中性
アミノ酸
|
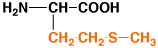
|
pKa:
2.28
9.21
|
|
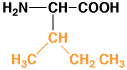
16
|
イソロイシン
|
isoleucine
|
I
|
Ile
|
6.0
|
1.00
|
|
中性
アミノ酸
|
|
pKa:
2.36
9.68
|
|
17
|
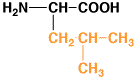
ロイシン
|
leucine
|
L
|
Leu
|
6.0
|
1.00
|
|
中性
アミノ酸
|
|
pKa:
2.36
9.60
|
|
18
|
チロシン
|
tyrosine
|
Y
|
Tyr
|
5.7
|
1.00
|
|
中性
アミノ酸
|
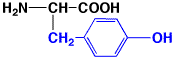
|
pKa:
2.20
9.11
10.13
|
|
19
|
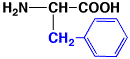
フェニルアラニン
|
phenylalanine
|
F
|
Phe
|
5.5
|
1.00
|
|
中性
アミノ酸
|
|
pKa:
2.16
9.18
|
|
20
|
βアラニン
|
β- alanine
|
|
βAla
|
|
0.44
|
|
|
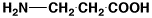
|
pKa:
3.55
10.24
|
|
21
|
βアミノ酪酸
|
β aminobutyric acid
|
|
|
|
0.44
|
|
|
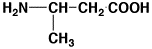
|
pKa:
|
|
23
|
アンモニア
|
ammonia
|
|
|
|
0.97
|
|
|
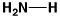
|
|
|
24
|
オルニチン
|
ornithine
|
|
Orn
|
|
1.12
|
|
|
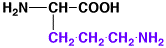
|
pKa:
1.71
8.69
10.76
|
|
25
|
リシン
|
lysine
|
K
|
Lys
|
9.7
|
1.10
|
|
塩基性
アミノ酸
|
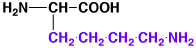
|
pKa:
2.16
9.18
10.79
|
|
26
|
トリプトファン
|
tryptophan
|
W
|
Trp
|
5.9
|
0.94
|
|
塩基性
アミノ酸
|
|
pKa:
2.43
9.44
|
|
27
|
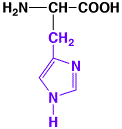
ヒスチジン
|
histidine
|
H
|
His
|
7.6
|
1.02
|
|
塩基性
アミノ酸
|
|
pKa:
1.82
6.00
9.17
|
|
28
|
アルギニン
|
arginine
|
R
|
Arg
|
10.8
|
1.01
|
|
塩基性
アミノ酸
|
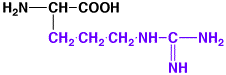
|
pKa:
1.82
8.99
12.48
|
特異なアミノ酸
Taurine
タウリンは強い酸ですから早く出てきます。また、感度よく特異的なので、基準(マーカー)として使われます。
Hydroxyproline
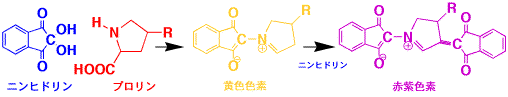
ヒドロキシプロリンはアスパラギン酸との分離が困難であるので、別に温度を変化させて分離する必要がある。また、ヒドロキシプロリンとプロリンは黄色物質(最大吸収波長
354 nm)と赤紫色物質(最大吸収波長 535 nm)が生成するので、440 nmで測定する必要がある。最初は黄色に発色し、長時間放置すると赤紫色になります。
|
|
|
プロリンおよびヒドロキシプロリン(R=OH)のニンヒドリン反応
|
Asparagine and Glutamine
この2つのアミノ酸は、加水分解の段階で、Asparagine は Aspartic acidに、Glutamine は Glutamic acidに100%加水分解されてしまう。
Cysteine and Cystine
システイン(Cysteine)はタンパク質中では普通シスチン(Cystine、ダイマーCys-Cys)として存在する。このアミノ酸は加水分解の条件では不安定で、収量は一定しない。システインを収量よく取るためには、加水分解前にシステインを安定なシステイン酸に酸化しておく必要がある。しかし、酸化は他のアミノ酸にも影響を与えるので、システインだけ別に分析する必要がある。また、フリーのシステインは容易にシスチンに酸化されてしまうので、分析は困難である。
|
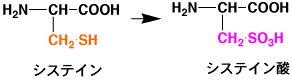
|
|
システインからシステイン酸への酸化
|
Amino sugars
アミノ糖の分析は他のアミノ酸から分離されやすいので容易であるが、加水分解段階で切断され易い。したがって、低温で短時間で分解する必要がある。
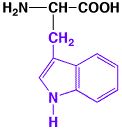
Tryptophan
トリプトファンは最も困難なアミノ酸で、加水分解で普通完全に破壊されてしまう。トリプトファンを取り出すには、水酸化バリウムで分解する必要で、この方法で定量的な分析が可能になる。
|