|
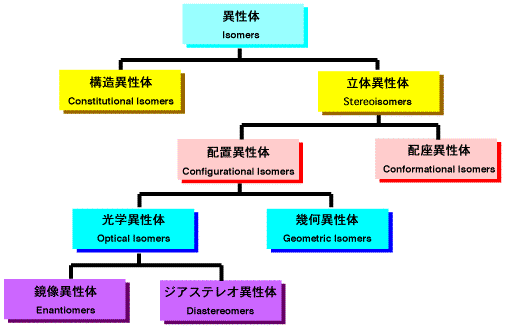
異性体とは、分子全体の化学組成は変わらずに、原子の配列の組み合わせが異なるものです。分類すると次のようになります。
 |
|
異性体の種類
|
構造異性体
原子の結合する順序を変えてできる異性体。
立体異性体
原子を空間で並び変えてできる異性体で、配置異性体と配座異性体があります。
配座異性体
シグマ結合を回転してできる異性体です。
配置異性体
結合を1度切断し、再度結合しないと他に変えることができない異性体です。
光学異性体と幾何異性体があります。
幾何異性体
二重結合に結合している置換基の空間的な配置が異なっている異性体です。
光学異性体
原子に結合している置換基の関係が三次元的に異なっている異性体です。
鏡像異性体とジアステレオ異性体があります。
鏡像異性体
鏡像関係にあって、重ね合わすことができない異性体です。
ジアステレオ異性体
互いに鏡像関係にはない異性体です。
構造異性体
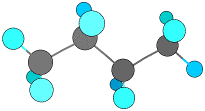
たとえば、C2H6Oでは、CH3-CH2-OH(エタノール)とCH3-O-CH3(ジメチルエーテル)の2種類の異性体がありますが、全く違うものです。このような原子の結合する順序を変えてできる異性体を構造異性体といいます。
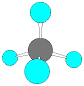
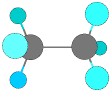
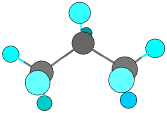
メタン、エタン、プロパンには異性体はありませんが、ブタンには構造異性体があります。
|
|
|
|
|
CH4 メタン
|
CH3-CH3 エタン
|
CH3-CH2-CH3 プロパン
|
|
|
|
|
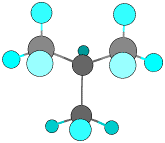
CH3-CH2-CH2-CH3
n-ブタン
|
CH3-CH(CH3)-CH3 i-ブタン
|
配座異性体
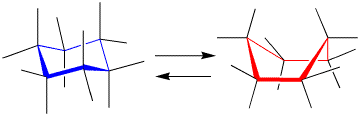
シクロヘキサンでは椅子型と船型の異性体がありますが、これらの間では、結合を切断しなくても折り曲げるともう1つのの異性体になります。折り曲げるとはシグマ結合を回転していることになります。
 |
|
椅子型(chair)型と船型(boat)のシクロヘキサン
|
幾何異性体
二重結合に結合している置換基の空間的な配置が異なっている異性体です。二重結合を持ったものはオレフィン(アルケン)ですが、二重結合の両側に置換基があると、異性体ができます。
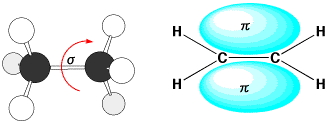
エタンでは、炭素−炭素結合には2個の電子が入っているのですが、電子の存在する位置は決まっていないので、炭素−炭素結合は自由に回転ができます(シグマ(σ)結合)。二重結合があるエチレンになると、炭素原子にはもう1つ電子があります。この電子は隣の炭素の電子と共有してパイ(π)結合を作ります。したがって、エチレンにはシグマ結合とパイ結合の2つの結合があることになります。ですから、エチレンの炭素ー炭素結合は回転することができないのです。
 |
|
σ結合(エタン)とπ結合(エチレン)
|
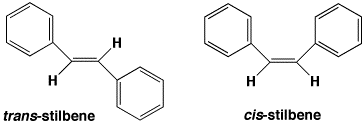
例えば、スチルベン(1,2-ジフェニルエテン)では、2つの異性体があります。ベンゼン環が同じ側にあるのがシス(cis,
z)型で、反対側にあるのがトランス(trans, E)型です。trans-スチルベンとcis-スチルベンは別の物質で、変換するためにはどこかの結合を切断して回転し、再び戻してやる必要があります。このような2つの化合物を異性体といい、このような二重結合を含む場合は幾何異性体といいます。
 |
|
トランススチルベンとシススチルベン
|
幾何異性体の表記法
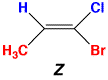
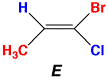
スチルベンの場合はシスとトランスでよかったのですが、二重結合にもう1つ置換基が付くと、どれとどれがシスかトランスかが分からなくなります。このような場合(三、四置換エチレン)にはEとZを使います。1-ブロモ-1-クロロプロペンの例を次に示します。
|
|
|
(1)二重結合の各炭素に付いている置換基について、重いものから順位をつける(Cahn-Ingold-Prelog順位則)。Br>Cl>CH3>H
(2)各二重結合について、順位の高い置換基を選ぶ。CH3とBr。
(3)2つの置換基が同じ側にあるか、反対側にあるかを調べる。
(4)同じ側にあれば、Z(ドイツ語のzusammen、一緒に)をつける。
(5)反対側にあれば、E(ドイツ語のentgegen、反対の)をつける。 |
光学異性体
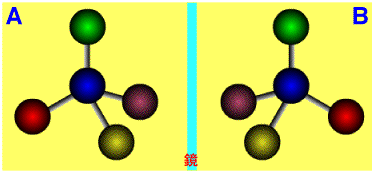
鏡像異性体
鏡像関係にあって、重ね合わすことができない異性体です。
炭素(青)に四種類の置換基が付いたものを考えます。左の化合物(A)を鏡に写すと右の化合物(B)になります。Aはどのように回転してもBにはなりません。もし、AをBにするには、赤の玉をはずして、向こう側から付けなおす必要があります。これが、光学異性体で、キラル化合物といい、青の炭素はキラル炭素(一般的にはキラル中心)といいます。また、この2つの異性体AとBは鏡像の関係にありますので、鏡像異性体、エナンチオマーと呼びます。キラル(chiral)とは、自分の鏡像と重なり合わないという意味で、分子がキラル(キラリティーがある)であれば鏡像体になります。キラリティーがない分子はアキラル(achiral)といい、鏡像体になりません。鏡像体の等量混合物をラセミ体(racemic
modification)といい、光学不活性ですがアキラルとは違います。
 |
|
鏡像体:右と左は鏡に写した関係になっている
|
光学異性体は、沸点、融点、UVスペクトルなどの物理的性質は同じです。ただし、偏光を当てると、その光を右に回転させるか、左に回転させるかの違いがあります。すなわち、旋光度が違いがあり、光学活性といいます。
普通の化学反応では違いはありませんが、キラルな化合物との反応では違いがあります。酵素はタンパク質からできていて、タンパク質はキラルなアミノ酸でできていますので、酵素はキラルな化合物を認識することができます。人間の手はキラルで、右手と左手は同じように見えますが、鏡像関係にあります。自分の右手で相手の右手とは握手ができますが、相手の左手とは握手ができません。軍手は右手でも左手も使えますが、革手袋は右手用と左手用とは違い、革手袋はキラルです。
アミノ酸には光学異性体があって、1つはL型、もう1つはD型です。我々の身体を作っているタンパク質はL型のアミノ酸からできています。次の図はアミノ酸の1つであるアラニンですが、1つの炭素に、H,
COOH, NH2, CH3の異なる置換基が付いていますので、キラルな化合物です。アミノ酸では、L-アラニン、D-アラニンのように名前を付けて区別し、人間のタンパク質に入っているアラニンは、L-アラニンです。
|
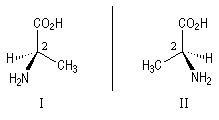
|
|
線は同じ面にあり(CH3とCOOH)、黒い線(NH2)は手前に、点線(H)は奥にあります。
|
 |
 |
|
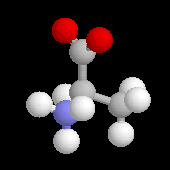
D-アラニン (R)
|
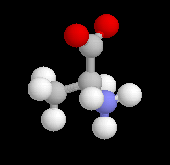
L-アラニン (S)
|
| 赤は酸素(O)、青は窒素(N)、灰色は炭素(C)、白は水素(H)を表します。R, Sは光学異性体の表記方です。 |
調味料に使われているグルタミン酸は、L-グルタミン酸で、おいしいと感じますが、D-グルタミン酸は味がありません。化学合成でグルタミン酸を作ると、L-グルタミン酸とD-グルタミン酸が半分ずつのラセミ体ができます。化学反応では区別できないからです。この混合物にキラルなアミンを加えると、どちらかのグルタミン酸と塩を作りますので、分離することができ(光学分割)、調味料のL-グルタミン酸にすることができます。
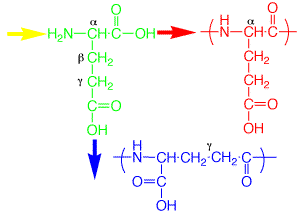
人間にはDのアミノ酸はありませんが、植物などにはDのアミノ酸があります。豆腐の成分にはタンパク質があって、グルタミン酸にアスパラギン酸が多いと説明しました。大豆を煮て納豆菌を加えると納豆ができます。納豆菌は大豆のタンパク質を分解し、グルタミン酸をD-グルタミン酸にしてから縮合し、ポリペプチド(ポリγグルタミン酸)を作りますが、これが納豆のネバネバの糸です。タンパク質とは違ったカルボン酸(γ)が縮合しますので、タンパク質ではありません。納豆の糸を分解しても、D-グルタミン酸になるので、調味料のL-グルタミン酸にすることはできません。
|
|
| グルタミン酸が黄矢印から赤矢印で縮合したのが普通のタンパク質、黄矢印から青矢印で縮合したのが納豆のポリγグルタミン酸 |
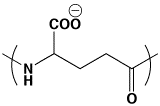
ポリ-γ-グルタミン酸は4−ナイロンと考えられ、しかも-COO-があるので水溶性のナイロンです。同じように塩基性のアミノ酸であるリジンも、αの-COOHとεのNH2で縮合すると、ポリ-ε-リジンができます。これは、6−ナイロンですが、NH3+があるので水溶性のナイロンです。
 |
 |
|
ポリ-γ-グルタミン酸
|
ポリ-ε-リジン
|
ポリ-ε, L-リジンは放線菌 Streptomyces albulus が菌体外に産生するもので、重合度が25〜30残基からなる直鎖上のポリマーです。これまでに、広い範囲の抗菌性が知られており、天然系の食品保存剤として利用されています。
細菌類の他,かび,酵母などの真菌類に有効です。抗菌作用はカチオン系の界面活性剤としての性質に基づくものです。微生物の細胞壁はマイナスの荷電を持っていますので、プラスに荷電したε―ポリリジンのアミノ基に吸着することによって増殖を阻害します。
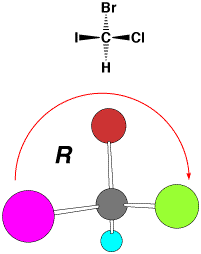
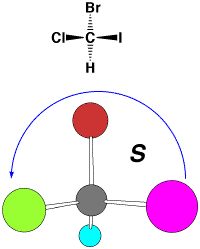
立体配置の表記法
アミノ酸の鏡像異性体はD, Lで表されていますが、すべての有機化合物の異性体を表すことができません。そこで、次のようにして、R,
Sで絶対配置を表します。糖の立体配置もD, Lで表されますが、アミノ酸のD, Lとは立体配置が反対になっています。
|
|
|
|
|
右回り(I>Br>Cl)→ R
|
|
左回り(I>Br>Cl)→ S
|
(1)キラル中心に結合している4つの原子、原子団の優先順位を順位規則(Cahn-Ingold-Prelog順位則)により決める。
順位規則
(a)原子番号の大きな原子が優先。I>Br>Cl
(b)優先順位が(a)で決められない時は、次の原子の位置で決める。
(c)二重結合、三重結合などは、原子が2つ、3つとして計算する。
(2)1番小さい原子(上ではH)を紙の裏側に向くように配置し、大きなものから矢印を書き、時計回りであればR(rectus、右)、反時計回りであればS(sinister,左)と表記する。 |
アミノ酸のL-アラニンをR, Sで表記すると、Sになります。生物は簡単に光学異性体を合成していますが、化学反応で区別して合成するのは困難です。キラル化合物の一方だけを合成する研究は、ノーベル賞を受賞された野依先生の研究が有名です。
糖の立体異性体
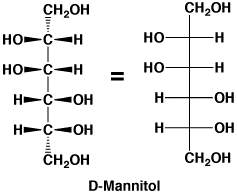
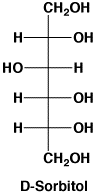
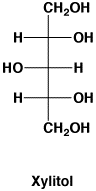
料理のだしに昆布が使われますが、昆布の旨さはL-グルタミン酸ソーダで、甘味はD-マンニトール(D-Mannitol)です。昆布の表面に白い粉が付いていますが、あれがD-マンニトール(別名D-マンニット)でカビや塩ではありません。果物や野菜の甘味は、マンニトールのほかD-ソルビトール(Sorbitol)(別名D-ソルビット)、キシリトール(Xylitol)(別名キシリット)があり、いずれも食品添加物です。これらは砂糖と同じように甘いですが、虫歯や糖尿にならずカロリーも少ないので、砂糖の代りに使われています。チューインガムの表面に付いている白い粉はキシリトールです。
立体構造を太線や点線で書く(D-マンニトールの左の図)のは厄介なので、次(D-マンニトールの右の図)のように直線で書くような約束があります(Fisher投影図)。
|
|
|
|
|
D-マンニトール(2つは同じもの)
|
D-ソルビトール
|
キシリトール |
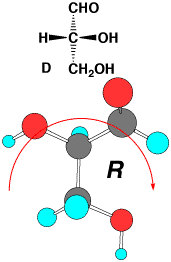
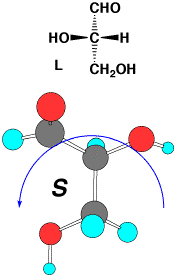
このような炭水化物の立体配置は、下のグリセルアルデヒドを基準にして決められます。この場合、酸素が炭素よりも原子番号は上なので、-OHが1番です。次に、アルデヒド(-CHO)とCH2OHは同じ炭素ですので、炭素の次に付いている原子で決めます。アルデヒドは-CH=Oですから、炭素の次にはHが1個とOが2個です。二重結合は2個付いていると考えます。CH2OHは、Hが2個とOが1個ですから、アルデヒドが優先します。1番小さい水素を紙の向こうに置いて、-OHから順に回すと、D-グリセルアルデヒドがRで、L-グリセルアルデヒドがSであることが分かります。糖やアミノ酸は昔から研究されていて慣れているので、それぞれのD,
Lを使ってもいい約束があります。
|
|
|
|
|
D-グリセルアルデヒド
|
|
L-グリセルアルデヒド
|
アノマー
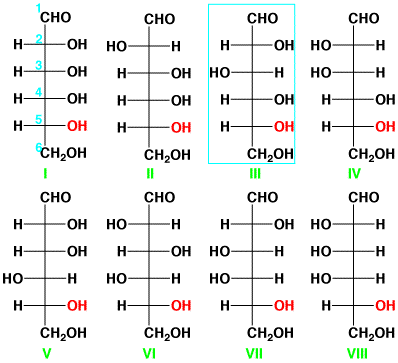
植物の葉の中では光合成が行われ、二酸化炭素と水から(+)-グルコース(glucose)ができます。この反応には、光とクロロフィルが必要です。この(+)-グルコースが結合して、セルロースやデンプンができます。デンプンを動物が食べて消化して(+)-グルコースにし、肝臓で再び結合してグリコーゲンにします。デンプン、セルロース、グリコーゲンの構成単位は(+)-グルコースです。(+)-グルコースは炭素の数が6個の6炭糖(ヘキソース)で、真中の4個の炭素がキラル炭素なので、16個の異性体が考えられます。5番目の-OHの位置を固定して考えると、次のような8個の異性体があります。それぞれ鏡像体がありますので、16個になります。E.
Fischerは、いろんな方法で(+)-グルコースは(III)の構造で、D-(+)-グルコースであることを決定し、ノーベル賞を受賞しました。
 |
|
D-(+)-グルコースの異性体
|
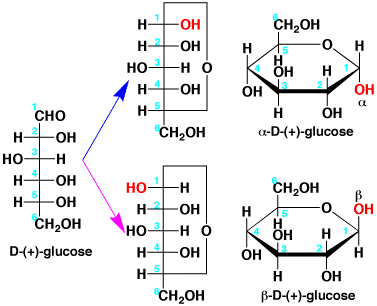
D-(+)-グルコースの1番目の炭素はアルデヒドですが、アルデヒドは酸(H+)があるとアルコールとアセタールを作ります。D-(+)-グルコースでは、1番目のアルデヒド(-CHO)が6番目にあるアルコール(-OH)と環状のアセタールを作ります。そうすると、1番目の炭素がキラルになるので、もう1つ異性体がでてきます。6角形の構造式では分かりやすいのですが、赤の-OHが面の上にあるか、下にあるかの違いです。下にあるのをα、上にあるのをβと名付け、α-D-(+)-glucose、β-D-(+)-glucoseとしました。αとβのようなジアステレオ異性体をアノマー(anomer)といいます。
|
|
| 1の-CHOと6の-OHでヘミアセタールができると環状になり、異性体(アノマー)ができる。 |
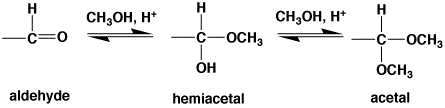 |
| アルデヒドは酸があるとメタノールが付いてヘミアセタールになり、さらにもう1つのメタノールと反応して、アセタールになります。この反応は平衡反応です。 |
アセタールができる反応は平衡反応ですから、α-D-(+)-glucoseに酸を加えると開環してD-(+)-glucoseになり、再び閉環すると、α-D-(+)-glucoseとβ-D-(+)-glucoseのアノマーになります。α-D-(+)-glucoseの比旋光度は+112°ですが、水に溶解すると徐々に減少して+52.7°になります。また、β-D-(+)-glucoseの比旋光度は+19°ですが、水に溶解すると徐々に増加して+52.7°になります。+52.7°は2つのアノマーを1:1で混合した時の価です。このような化合物の旋光度が変化して、平衡値に達することを変旋光といいます。比旋光度については、いずれQ&Aで詳しく説明いたします。
ジアステレオ異性体
互いに鏡像関係にはない立体異性体です。配座異性体や幾何異性体も鏡像関係にはない立体異性体ですから、ジアステレオ異性体です。
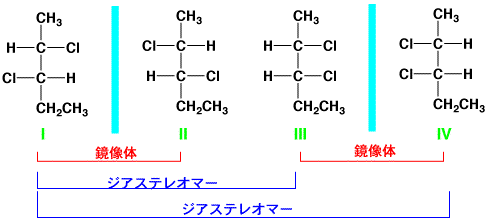
キラル炭素が分子中に1個あれば鏡像体がありますが、キラル炭素が2個以上あると複雑になります。2, 3-ジクロロペンタンには次の4つの異性体があります。IとII、IIIとIVは鏡像体です。しかし、IとIIIは立体異性体ですが、鏡像異性体ではありません。このような互いに鏡像関係にない立体異性体をジアステレオマーといいます。
 |
|
IとII、IIIとIVは鏡像体、IとIII, IV(IIとIII, IVも)はジアステレオマー
|
このようなジアステレオマーの命名法ですが、上の構造(I)で説明します。この構造で、上端の-CH3を1とし数えると2,
3-ジクロロペンタンになりますが、下端の-CH3を1として数えると、3, 4-ジクロロペンタンになります。命名法では数字が小さい方にするので、2,
3-ジクロロペンタンが正しい名前になります。
次に、2番目のキラル炭素はSで、3番目のキラル炭素もSです(RかSかは上の説明を見て考えてください)。したがって、構造(I)は(2S,
3S)-2, 3-ジクロロペンタンと表しますが、数字は必ずしも必要ではなく、(S, S)-2, 3-ジクロロペンタンとも表記できます。ちなみに、構造(II)は(2R,
3R)、構造(III)は(2S, 3R)、構造(IV)は(2R, 3S)です。
なお、上の表で構造(I)で、2つのClは反対側に書いてありますが、C2-C3の結合は単結合で回転が自由ですので、transとかcisとかはいいません。
|