|
2/3のリンゴ
電子や分子の話はデジタルですから、1個、2個、3個...というようになり、半分とか3分の2とか2.3個とかのアナログの話はでてきません。しかし、実際の現象を説明するには、デジタルではなくアナログでの説明が必要な場合があります。果物屋さんで売っているリンゴも、1個、2個と売っていて、3分の2個とかは売っていません。サファイアの青を説明するには、3分の2個のリンゴの考えが必要なので、次の話を読んで下さい。
 O君とH君は兄弟です。二人は散歩に出ましたが、途中でお腹が空いてきました。果物屋さんがあったので、リンゴを買おうとしました。リンゴは1個200円でしたが、お母さんから貰ったのは、それぞれ100円でしたので、リンゴが買えません。そこで、それぞれ100円を出して1個のリンゴを買いました。本当なら半分ずつにするところが、お兄ちゃんのO君は強いので半分以上の3分の2を食べてしまいました。弟のH君は3分の1しか食べれませんでした。お兄
ちゃんは、リンゴは1個しかないのに、アナログを利用してたくさん食べてしまったのです。 O君とH君は兄弟です。二人は散歩に出ましたが、途中でお腹が空いてきました。果物屋さんがあったので、リンゴを買おうとしました。リンゴは1個200円でしたが、お母さんから貰ったのは、それぞれ100円でしたので、リンゴが買えません。そこで、それぞれ100円を出して1個のリンゴを買いました。本当なら半分ずつにするところが、お兄ちゃんのO君は強いので半分以上の3分の2を食べてしまいました。弟のH君は3分の1しか食べれませんでした。お兄
ちゃんは、リンゴは1個しかないのに、アナログを利用してたくさん食べてしまったのです。
 お兄ちゃんのO君は、100円出したので1/2のところ、2/3を食べました。電子が1個加われば−1ですが、2/3-
1/2 = 1/6, 6分の1ですので、お兄ちゃんは少し電子が多いことになり、これはδ-(デルタマイナス、δデルタは少しの意味です)になります。 お兄ちゃんのO君は、100円出したので1/2のところ、2/3を食べました。電子が1個加われば−1ですが、2/3-
1/2 = 1/6, 6分の1ですので、お兄ちゃんは少し電子が多いことになり、これはδ-(デルタマイナス、δデルタは少しの意味です)になります。
弟のH君は、1/6の電子が足りないので、δ+になります。電子を1個ではなく、部分的にやり取りした場合は、このようにδ-、δ+で表します。
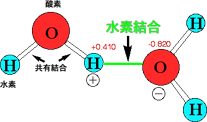
水分子のO-Hの間には電子の軌道があって、2個の電子が回っています。もともとは酸素から1個、水素から1個の電子を出して作った軌道ですが、酸素は強いので、電子は酸素の方に引き寄せられています。そのため、酸素はOδ-、水素はHδ+になり、水素結合ができます。 |
O-Hの結合は熱を加えると切れますが、その時はそれぞれ電子を1個持って切れます(1)。しかし、水の中では、酸素が電子を2個取ってO-になり、電子を取られた水素はH+のイオンになります(2)。これらは、電子を1個ずつやり取りしていますが、電子の3分の2、3分の1のやり取りが重要な場合もあります。
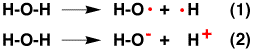
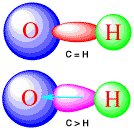
水、タンパク質、核酸では水素結合が重要であると述べました(Q50)。H2Oでは、分子の間で、水素(-H)と酸素(-O-)の間に弱い結合ができていて、それが水素結合でした。水分子のO-Hの間には電子の軌道があり、そこに電子があって結合ができています。もともとは酸素と水素が1個ずつ電子を出して作った共有結合ですが、その軌道では酸素が強いので電子を引っ張っていますから、酸素の周りに電子が集まり、水素の周りの電子は少なくなっています。電子が完全に酸素の方に移れば、酸素や水素はイオン(O-,
H+)になりますが、そこまでは移動していなく偏っているだけですから、Oδ- Hδ+と書きます。δ-とδ+の間には静電的な引力が働きます。電荷移動錯体とは、このように電子が移動してイオンにはなっていませんが、電子が偏った状態で引き合い、安定な状態になっています。
 |
|
 |
|
水分子の水素結合
|
|
O-H結合の電子の偏り
|
電荷移動錯体
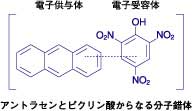
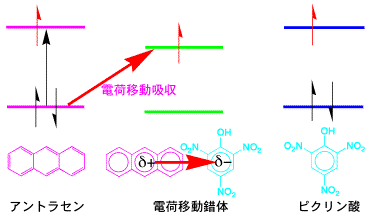
ピクリン酸(2,4,6-トリニトロフェノール)は,フェノールに電子を引っ張る力が強いニトロ基(-NO2)が3つも結合しています。それで、ピクリン酸のベンゼン環は電子が不足しています。一方、アントラセンなどの芳香族化合物は、電子を沢山持っています。この2つの化合物を混合すると、電子の多いアントラセンは、電子の少ないピクリン酸に電子を部分的に与えて電荷移動錯体ができます。電子が完全に移動すればイオンになり、(アントラセン)+
と(ピクリン酸)-の塩ができますが、電子の移動は1個ではなく部分的に起っています。
アントラセンが電子供与体(D)、ピクリン酸が電子受容体(A)の電荷移動錯体ができます。アントラセンとピクリン酸を混合したわけですが、吸収スペクトルを測定すると、それぞれの吸収スペクトルを重ね合わせたものにはならず、新しい波長領域に電荷移動錯体に固有の吸収が現れます。DからAに部分的に電子が移動して、Dδ+とAδ-ができ、新しい結合(Dδ+----Aδ-)ができたと考えられます。新しい吸収体(電荷移動吸収帯)は錯体によるもので、黄色などの着色が見られるのが普通です。
 |
|
電荷移動錯体は安定でエネルギーレベルが低い
|
簡単な組み合わせでは、ベンゼンとヨウ素があります。ヨウ素からベンゼンに電荷移動が起り、黄色から茶色に着色します。金属錯体の配位結合は電荷移動力によって形成されるので,配位結合に特有の電荷移動吸収帯が観測されます。電荷の移動は、金属イオンから配位子へ、配位子から金属イオンの2種類があります。
サファイアとルビー
サファイアは青い宝石ですが、その成分のほとんどは赤い宝石のルビーと同じで、酸化アルミニウム(Al2O3)です。ルビーは不純物としクロムが入っているのですが、サファイヤは鉄(Fe)とチタン(Ti)が入っています。しかし、酸化アルミニウムに鉄を加えても、チタンを加えても青くはならないので、鉄とチタンの間に何かがあると考えられます。それは、電荷移動錯体ができているからです。
サファイヤの青を説明するには、鉄やチタンの電子の状態を説明する必要があるので、まずQ62の「白い硫酸銅を水に溶かすと、どうして青くなるのですか?」とQ63の「ルビーはなぜ赤い」を読んでから、このQ64に戻ってきて下さい。
サファイアの青の理解には、アルミニウム、鉄、チタンの3つの金属の性質を知る必要があります。
 |

サファイア
(Saffaia)
|
チタン
|
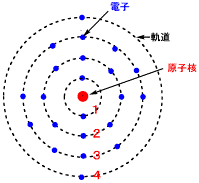
チタン原子の電子軌道
|
チタン(Ti: Titanium)は原子番号22の遷移元素で、クロム、鉄、銅も同じ遷移元素です。軽くて錆びずアレルギーを起こさないので、アクセサリー、眼鏡フレーム、ゴルフクラブなどに使われています。チタンの表面に薄い酸化膜(TiO2)ができると、透明なので光の干渉によりきれいな虹色に見えます。CDの虹色やシャボン玉の虹色と同じ原理です。
チタンの多くは、二酸化チタン(TiO2)として白色顔料、絵具、塗料などに使われてるほか、紫外線(UV)をカットするので化粧品にも使われています。また、最近、二酸化チタンが光を吸収して水や有機物を分解することから、光触媒としても注目されています。
さらに、塩化チタン(TiCl4)はエチルアルミニウム(AlEt3)と組み合わせると、チーグラー・ナッタ触媒(Ziegler
Natta catalyst)として、エチレンやプロピレンなどのオレフィンの重合に用いる触媒として有用です。チーグラーはドイツの研究者、ナッタはイタリアの研究者ですが、二人は、これらの業績により1963年、揃ってノーベル化学賞を受賞しました。
チタン原子の電子は22個で、3dに2個4sに2個の電子が入っています。1〜6個の電子が抜けて、+1〜+6までの酸化状態がとれますが、+3が最も安定な状態です。↑の電子が抜けてチタンイオンになります。
|
主量子数
|
副量子数
|
合計
|
|
| |
s
|
p
|
d
|
22
|
|
|
1
|
↓↑ |
|
|
|
|
|
|
|
|
2
|
1s |
|
2
|
↓↑ |
↓↑ |
↓↑ |
↓↑ |
|
|
|
|
|
8
|
2s + 2p |
|
3
|
↓↑ |
↓↑ |
↓↑ |
↓↑ |
↑ |
↑ |
|
X
|
X
|
10
|
3s + 3p + 3d |
|
4
|
↑↓X |
X
|
X
|
X
|
|
|
|
|
|
2
|
4s |
|
チタンTi原子の電子配置 X:[Ti(H2O)6]3+
|
鉄
鉄(Fe, Iron)は我々に最もなじみのある金属ですが、原子番号は26の遷移元素です。純粋な鉄は白い光沢を持っていますが、直ぐに錆びて黒くなります。錆を抑制するには、クロム等との合金にするとステンレスになり錆びません。
酸化鉄には、黒錆の酸化鉄(II, III)(Fe3O4)と、赤錆の酸化鉄(III)(Fe2O3)があります。黒錆は、含まれる鉄の酸化数が、II
: III = 1 : 2です。黒い磁鉄鉱は酸化鉄(II, III)で、天然に産出する磁石です。酸化鉄(III)は、非常にもろい赤褐色の固体で、還元して金属鉄を得るための赤鉄鉱です。ベンガラなどの赤色顔料、磁気テープなどに使われています。
赤錆はベンガラとして古代より使われてきた赤色顔料です。京都や奈良に行くと、ベンガラを塗った赤い鳥居やお寺や神社の建物があります。ベンガラの成分は酸化第二鉄(酸化鉄(III)、Fe2O3)です。着色力・隠蔽力が大きく、耐熱性・耐水性・耐光性・耐酸性・耐アルカリ性のいずれにも優れており、安価で無毒で人体にも安全なため非常に用途は多いです。セメントやプラスチック、ゴムの着色、塗料・インク・絵具等に用いられます。
鉄の酸化数は:2,3,4,5,6で、2価と3価が安定です。
|
主量子数
|
副量子数
|
合計
|
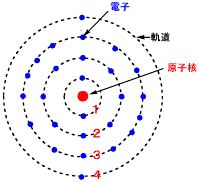
鉄原子の電子軌道
|
| |
s
|
p
|
d
|
26
|
|
1
|
↓↑ |
|
|
|
|
|
|
|
|
2
|
|
2
|
↓↑ |
↓↑ |
↓↑ |
↓↑ |
|
|
|
|
|
8
|
|
3
|
↓↑ |
↓↑ |
↓↑ |
↓↑ |
↓↑ |
↑
|
↑
|
↑
|
↑
|
14
|
|
4
|
↑↓X |
X
|
X
|
X
|
|
|
|
|
|
2
|
|
鉄Fe原子の電子配置 X: [FeCl4]-
|
サファイアの青
サファイア(sapphire)には鉄とチタンが含まれ、Fe2+とTi4+の間で電荷移動錯体ができます。鉄は3価(Fe3+)が安定ですので、Fe2+はFe3+になろうとします。一方、チタンも3価(Ti3+)が安定ですから、Ti4+はTi3+になろうとします。そこで、Fe2+から電子が部分的にTi4+に移動して、電荷移動錯体ができ、600
nmから1000 nmにかけて可視光線の吸収が見られます。これがサファイアの電荷移動吸収帯で、吸収されない青色の光を反射するので、サファイアは青く見えるのです。もちろん、鉄だけやチタンだけが酸化アルミニウムに含まれても、600
nmから1000 nmにかけて可視光線の吸収は見られません。鉄やチタンが酸化アルミニウムに含まれる場合は、もっとエネルギーの高い、短い波長の光を吸収するので、全ての可視光線の光を反射することになり白く見えます。
このような電荷移動は、複数の金属原子を持つ多核錯体などで見られ、原子価間電荷移動(Intervalence Charge Transfer,
IVCT)と呼ばれます。同じ原子でも、Fe2+ - Fe3+のように酸化状態が異なるイオン間でも見られます。この相互作用により吸収スペクトルでは赤色の光を吸収するので、このような相互作用が見られる鉱物では、青または緑に見えます。鉱物の中にはTi3+
- Ti4+ を含むものもあり、同じく電荷移動が見られ、青色の鉱物になります。サファイアでは、Fe2+
- Fe3+と Fe2+ - Ti4+ 両方の原子価間電荷移動による相互作用が起っていると言われています。
紺青と呼ばれる濃青色の顔料も鉄の化合物で、ヘキサシアノ鉄(II)酸塩と鉄(III)塩を、もしくはヘキサシアノ鉄(III)酸塩と鉄(II)塩を混合することによって沈殿する濃青色の顔料です。組成式はFe(III)4[Fe(II)(CN)6]3ですが、結晶水を含んでいたり一部の鉄イオンが置換されていたりするので、一定の組成のものを得ることは困難です。そのためヘキサシアノ鉄(II)酸塩と鉄
(III)塩から得られたものはプルシアンブルーあるいはベルリンブルー、ヘキサシアノ鉄(III)酸塩と鉄(II)塩から得られたものはターンブルブルーというように別の物質と考えられていました。しかし、これらは実際は同じ化合物であることが確認されています。
結晶構造はFe3+イオンが面心立方格子を形成し、その立方体の各辺の中点にFe2+イオンが位置しています。そしてFe3+イオンとFe2+の間にはCN-イオンが位置しています。CN-イオンは窒素原子でFe3+イオンに、炭素原子でFe2+に配位しています(Fe3+←NC→Fe2+)。このような結晶構造をとる一群のシアン錯体の塩をこの化合物を代表としてプルシアンブルー型錯体といいます。プルシアンブルー型錯体には強磁性やフェリ磁性を示すものが多く知られています。
|