|
酸素と酸化
酸化(oxydation)とは、酸素(oxygen)と反応して酸化物を作る反応で、たとえば、銅や鉄が酸化して赤や黒のさびである酸化物ができる反応などです。木材や紙などの有機物(セルロース)が酸化(燃焼)されると、炭酸ガス(CO2)と水(H2O)ができます。
また、食品を放置すると腐りますが、これは、食品の成分が酵素によって酸化されたためです。キリヤ化学のホームページには様々な有機色素がありますが、このような有機色素が酸化されると、色が消えて無色になります。
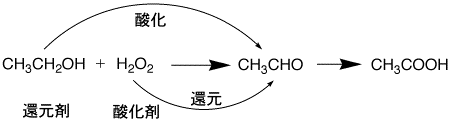
お酒(エタノール: CH3-CH3-OH)は過酸化水素(H2O2)で酸化されて、アセトアルデヒド(CH3-CHO)になります。さらに酸化されると、酢酸(酢)になります。ここで、過酸化水素は酸化剤で、エタノールを酸化したのですが、自分自身はエタノールで還元されたことになり、エタノールは還元剤になります。
 |
|
エタノールの酸化反応
|
空気中には、窒素、酸素、炭酸ガスなどがありますが、酸素にはこのように物質を酸化させる働きがあります。食品が腐るのは困りますが、酸素はわれわれの身体に重要な物質で、人間は酸素が無いと死んでしまいます。全ての生物にとって酸素が必要かと言うと、そうでもなく、人間にとって毒である、青酸ガス(HCN)や硫化水素ガス(H2S)で生きているものもあります。地球上に酸素ができるまでは、これらのガスがありましたので、これらの生物はその時代の生物でしょう。
酸素の性質
 |
 |
|
酸素原子
|
酸素分子
|
酸素は電子が8個の原子ですが、外側の6個の電子が結合に関係します。普通は空いた軌道に順に電子が入っていくのですが、酸素では2つの空いた軌道に、電子が一個ずつ入ります(●)。軌道に電子が1個だけ入った状態がフリーラジカル(不対電子)で、他の原子や電子と反応しやすい活性な状態です。
酸素分子は、不対電子どうしで結合しますが、やはり不対電子が1個ずつ残ります。これらの不対電子は回転方向(スピン)が同じであり、1つの軌道に同時には入れません(フントの法則)。酸素分子は不対電子を有するビラジカル
(biradical) で、電子のスピンが同じなので、三重項酸素と呼ばれます。酸素が他の物質を酸化したりする能力は、この活性なラジカルのせいです。
酸素分子はこのように活性なフリーラジカルを持っているので、他の分子に結合して安定になろうとします。これが、酸化反応です。物質を酸化させるものは酸化剤といいます。金属の銅が酸素に触れると、ラジカルが銅に結合しますが、不安定な過酸化物ですから、酸素原子が抜けて酸化銅CuOになります。銅が酸化されて電子が2個抜け、その電子(●)が酸素に与えられたことになります。CuOの結晶構造では、Cuの周りにOが4個あるような構造ですから、四角形が横に連なったようなものです。
物質が酸素と反応する以外にも、物質から水素が奪われる反応も酸化反応です。これらの反応で共通することは、物質の電子が失われていることです。したがって、一般的には「酸化反応とは物質の電子が失われること」になります。
還元とは酸化の逆の反応ですが、「物質が電子を受け取る化学反応」であり、具体的には物質から酸素が奪われる反応、または物質が水素と結合する反応のことです。もちろん、生体でも酵素による還元反応があります。
酸化の状態を表すのに、酸化数が使われることもあります。酸化数(oxidation state)とは、対象原子の電子密度が、単体であるときと比較してどの程度かを知る目安の値です。
酸化とはある原子が電子を失うことであるので、単体であったときより電子密度が低くなっています。 還元とはある原子が電子を得ることであるので、単体であったときより電子密度が高くなっています。ある原子が酸化状態にある場合、酸化数は正の値をとり、その絶対値が大きいほど電子が不足の状態にあることを示します。逆に還元状態にある場合には負の値をとり、その絶対値が大きいほど電子が過剰の状態にあることを示します。
|
酸化と還元の定義
|
| |
酸 化
|
還 元
|
| 酸素のやり取り |
酸素と結合 |
酸素を失う |
| 水素のやり取り |
水素と結合 |
水素を失う |
| 電子のやり取り |
電子を失う |
電子を受け取る |
| 酸化数 |
増加 |
減少 |
活性酸素
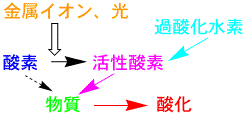
物質が酸素と触れても、そう簡単には酸化しませんが、金属等の触媒、酵素、光があると、容易に酸化が起ります。これは、酸素が活性な活性酸素になったからです。活性酸素は不安定で、強い酸化作用を持っていますが、寿命が短いのですぐに活性が無くなってしまいます。活性酸素が身体の中でできると、生体を傷つけるので危険ですが、生体にはこれを分解するシステムがあるので、そんなに心配することはありません。
 |
|
酸素、活性酸素、酸化
|
活性酸素には、スーパーオキシドアニオンラジカル、ヒドロキシルラジカル、過酸化水素、一重項酸素などがあります。過酸化水素以外のの活性酸素は寿命が短いので、存在を確認するのが難しく、特殊な機器が必要です。
|

|

|
 |
 |
 |
|
酸 素
(三重項酸素)
|
スーパーオキシド
アニオンラジカル
|
ヒドロキシル
ラジカル
|
過酸化水素
|
一重項酸素
|
|
O2
|
O2-
|
HO・
|
H2O2
|
1O2
|
スーパーオキシドアニオンラジカル(O2-)は、酸素に電子が1個加わってアニオンラジカルになったもので、不対電子が1個残るので、アニオンラジカルです。酸素から光や触媒でできますが、非常に活性が高く、短時間でヒドロキシルラジカル(HO・)になります。生体内では、酵素によってできますが、細菌をやっつける重要な役目があります。余分のスーパーオキシドアニオンラジカルは、やはり酵素によって分解され、過酸化水素になりますが、過酸化水素は別の酵素で分解され、無害化されます。
ヒドロキシルラジカル(HO・)は、水酸基(OH)のラジカルですが、活性酸素の中では最も反応性が高い、強い酸化力を持っています。生体を構成している、タンパク質、糖質、脂質を酸化します。過酸化水素から、光照射や鉄触媒などで生成します。身体の中のヒドロキシルラジカルを除くには、ベータ−カロテンやビタミンEなどが有効です。
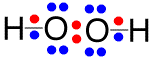
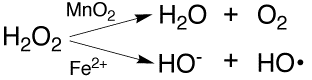
過酸化水素(H2O2)はラジカルではないので、活性ではないように見えますが、容易に酸素やヒドロキシラジカルを発生しますので、活性酸素に分類されます。殺菌、消毒用に販売されているオキシフルなどは、3%程度の水溶液ですが、30%の過酸化水素水は工業的にも重要な試薬です。過酸化水素から、二酸化マンガン(MnO2)により酸素が発生し、鉄触媒(Fe2+)によりヒドロキシルラジカルが発生します。空気中の酸素とアントラヒドロキノンを混合すると、アントラヒドロキノンが酸化されてアントラキノンと過酸化水素が生じる反応を利用して、工業的に過酸化水素が生産されています。
|
|
|
過酸化水素の反応
|
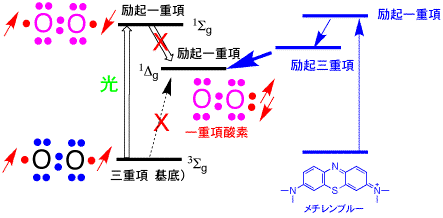
一重項酸素は活性酸素の一種ですが、不対電子を持たないのでフリーラジカルではありません。しかし、空の軌道があって、そこに電子が入りやすいので、活性な酸素です。フリーラジカルの一種ではないが、空になった電子軌道が電子を求めることにより強い酸化力を持っています。
酸素分子に紫外線を照射すると、電子のスピンが反対になった励起一重項状態(1Sg)になります。酸素の励起一重項状態には、もう一つの状態が(1Dg)があり、この状態が安定で、一重項酸素といわれます。しかし、基底状態の三重項状酸素に光を当てると、1Sg状態にはなりますが、1Sgから1Dgへの移動(項間交差)がほとんど起こりません。また、三重項状酸素から直接1Dgへの励起は禁じられています(禁制遷移)。一重項酸素を作るには、ローズベンガルやメチレンブルーなどの色素を光で励起し、色素の一重項励起状態→三重項励起状態に移動し、さらに酸素分子にエネルギーが移動することにより生成します。電子スピンの方向が反対なので、一重項酸素と言います。生体内においても、紫外線を浴びたりすることにより体内の色素が増感剤の役目をして一重項酸素が発生することがあります。生体内の一重項酸素も、ベータ−カロテンやビタミンEなどにより除去されます。
 |
|
一重項酸素の合成法
|
オゾン (Ozone、O3) は、酸素原子3つからなる活性で強い酸化作用がある物質ですが、活性酸素の仲間ではありません。
金属イオン触媒
 |
|
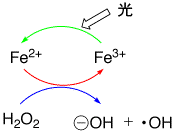
フェントン反応
|
過酸化水素は酸化剤として使われますが、それだけではなかなか反応しません。しかし、鉄などの金属イオンがあると、強力な酸化剤となります。Fe2+とH2O2の組み合わせは、フェントン反応(Fenton試薬)として有名で、酸化剤またはラジカル発生剤となります。ヒドロキシルラジカル(HO・)が発生するからですが、ビニルモノマーのラジカル重合触媒になります。Fe2+はFe3+になりやすく、電子を与える役割をします。過酸化水素は分解して2個のヒドロキシルラジカルになりますが、これは再び結合して過酸化水素に戻ってしまいます。もし、Fe2+があれば、電子をHO・に与えてHO-になるので、元の過酸化水素には戻れず、1個のHO・が取り残されてしまいます。このようにして発生したHO・が酸化反応に使われます。
Fe2+はH2O2に作用してHO・を出し、自身はFe3+になりますが、Fe3+はH2O2を分解する能力がありませんので、反応はそれで終わりです。しかし、光があれば、Fe3+をFe2+に変えますので、反応は繰り返されることになります。したがって、鉄イオンー過酸化水素ー光の系は、強力な酸化剤になるのです。
東北大学大学院農学研究科の遠藤泰志先生は、マヨネーズの酸化反応を研究されました。マヨネーズは卵黄と植物油から作られますが、酸化された成分の分析は、微量であるために困難でしたが、卵黄に由来するタンパク質と考えられました。。酸素による酸化はラジカル反応ですから、ラジカルの発生を抑制するラジカル阻害剤を添加しましたが、酸化を抑えることができませんでした。そこで、金属イオンとキレートをつくるEDTAを加えました。光によって酸化反応が進行することが分かったのですが、金属イオンをEDTAで抑えると、光を照射しても酸化は起こりませんでした。金属イオンの種類は、非常に微量であるために特定はできませんでした。
この結果から、おそらく金属イオンは鉄であり、鉄イオンはタンパク質と錯体を形成して、これに光が当たることで触媒となって酸素を活性化して、タンパク質を酸化したと考えられます。鉄イオンは単独よりも錯体になると活性になることがわかっています。マヨネーズの酸化を抑制するためには、酸素、金属イオン、光、のいずれか、またはすべてが無い状態にすればよいわけです。金属イオンは極微量なので、除去することは困難です。以前、マヨネーズはガラスの容器に入っていましたので、酸素が侵入することはありませんでした。しかし、使いやすさのために、現在はポリエチレンの容器に入っています。ポリエチレンは水は通さないのですが、酸素を通しますので、ポリエチレンだけでは酸素が中に入って、マヨネーズが腐ってしまいます。酸素を通さないプラスチックは、ポリ塩化ビニリデンやエバール(エチレンとビニルアルコールの共重合体)です。そこで、これらのプラスチックとの多層構造により、酸素の侵入を抑えています。光が入らないフイルムを使うと完璧ですが、食品は中身が見えた方がよいとの理由で、使われていません。
光による酸化
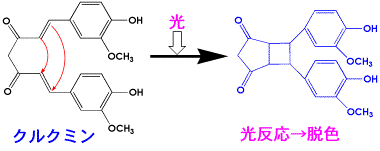
光によって反応するものがあります。天然色素のウコンは光によって反応します。光によって反応して性質が変化するプラスチックは、感光性樹脂で、工業的に重要な材料です。光によって文字や写真を焼きつけて印刷版にしたり、半導体を作るために使われるフォトレジストなどです。ウコン色素の成分であるクルクミンは、桂皮酸の誘導体ですが、同じような誘導体は感光性樹脂にも含まれています。光照射によって二量体ができて、溶解性が変わるためです。二重結合に電子を引っ張るカルボニル基と、電子を押し出すベンゼン環があると、ラジカルが安定化し、光で反応しやすいのです。
 |
|
ウコン色素(クルクミン)の光反応
|
光だけで反応する物質は限られたものですが、酸素、金属イオンがあると光による酸化反応が進みます。酸化チタンは光触媒として有名ですが、光が無ければ反応しません。光反応するためには、光を吸収する必要があります(光化学の第1法則)。ポリスチレンは光を吸収するので光反応しやすく、日光に当てるとぼろぼろになってしまいます。ポリエチレンは光を吸収しませんが、酸素を吸収するので、光が当たるとポリエチレンでも光反応します。
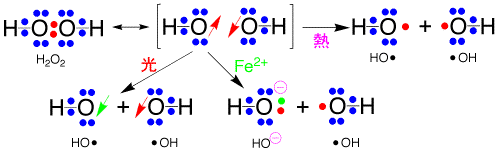
過酸化水素H2O2のO-Oの結合は不安定で、熱を加えると分裂してラジカル(HO・)になります。しかし、途中から、元のH2O2に戻ってしまいやすいのです。これは、ラジカルがもともと結合に使われていたので、スピンが反対向き(↓↑)だからです。光を照射して、1つのスピンを反対に向けると(↓)、同じ向きのスピン(↓↓)になってしまいますので、元のように結合してH2O2には戻れず、ラジカル(HO・)ができるのです。
もしFe2+があると、Fe2+からラジカルに電子を1個与えてイオンになり(HO・→ HO-)安定になるので元には戻れません。したがって、1個のラジカル(HO・)が残るのです。このように、過酸化水素だけでは、なかなか酸化には使われにくいのですが、光を当てたり、鉄のイオンがあると、どんどん分解してラジカルができ、酸化に使われるのです。
過酸化水素の分解はアミンも触媒になります。これは、アミンと過酸化物がコンプレックスを作り、反応が容易になるからです。
 |
|
過酸化水素の分解
|
色素の酸化
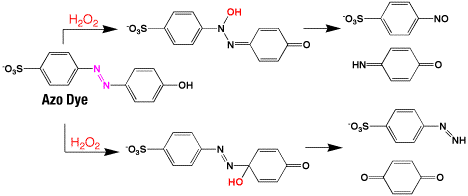
色素は光を吸収するので、光反応がしやすいのです。色素が光エネルギーを吸収すると、励起状態になります。そのエネルギーは光を出して基底状態に降りるか、他の物体にエネルギーを与えるか、自分自身がそのエネルギーで反応するかです。反応は異性化や他の物体との反応などで、酸素との反応では酸化になります。アゾ色素は安定な色素ですが、酸化では次のような反応が起こり、二重結合が分解します。二重結合がなければ色は無くなります。アゾ色素は-N=N-基を持った色素ですが、過酸化水素による酸化反応により二重結合は無くなり、最後には切断されてしまい脱色されます。
 |
|
アゾ色素の酸化反応
|
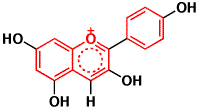
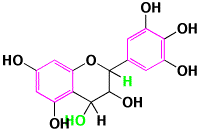
このホームページでも、キリヤスレッドRC-Nの光退色実験が掲載されています(http://www.kiriya-chem.co.jp/ruchin/ruchin6.html)。用いた色素はアカキャベツ色素で、アントシアニン系の色素です。アントシアニンの色素成分はアントシアニジンですが、無色のロイコアントシアニジンから脱水されて生合成されたものです(http://www.kiriya-chem.co.jp/q&a/q59.html)。
アントシアニジンと基本骨格は同じでも、二重結合が無くなると、無色になることは、Q&A60で述べました(http://www.kiriya-chem.co.jp/q&a/q60.html)。フラバノールではH2が付加した形に、ロイコアントシアニジンでは、H2Oが付加した構造です。
 |
 |
|
アントシアニジン
|
ロイコアントシアニジン
|
赤キャベツ色素はアントシアニンですが、酸化によって次のような反応が考えられます。ラジカル(例えばヒドロキシルラジカル)がアントシアニン(A)のカテコール部分の-OHから水素ラジカルを取り、ラジカルになります(B)。さらにもう1つのラジカルが働き、水素ラジカルを取ります(C)。電子の組換えで、酸化されたアントシアニン(D)になります。(D)では、ベンゼン環がキノンに変わってしまったので、共役ができず、色が消えてしまいます。アントシアニンはこのように酸化されやすいので、他の物質の酸化を抑制する抗酸化剤としても知られています。
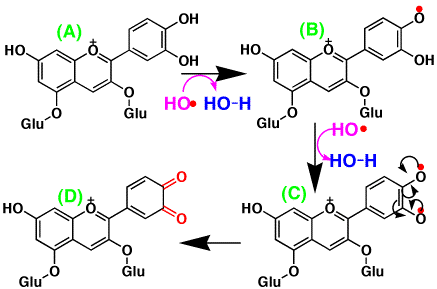 |
|
赤キャベツ色素の酸化反応
|
酸化防止剤
色素の脱色反応はラジカル反応で、しかも反応は連鎖反応であるから、一度開始すると連鎖的に進行します。脱色反応が起らないようにするためには、(1)酸素、金属イオン、光を無くして反応が開始されないようにするか、(2)始まった連鎖反応を途中で停止させるかの手段をとる必要があります。容器に入っている場合は(1)の反応の開始を抑える方法をとることもできますが、空気に触れ光に曝される場合は、(2)の連鎖をストップさせる方法が有効です。
ビタミンC
赤キャベツ色素(アントシアニン)の水溶液を透明ビンに充填し、屋外で日光照射すると、7日間で脱色されてしまいます。食品の酸化防止剤として知られているビタミンCを添加すると、ビタミンC(0.0001%)では耐光性が向上したが、0.001%以上添加すると逆に耐光性は弱くなった。

対照 (1) (2) (3) (4) |
| |
対照
|
(1)
|
(2)
|
(3)
|
(4)
|
| 赤キャベツ色素 |
0.001 |
0.001 |
0.001 |
0.001 |
0.001 |
| ビタミンC |
− |
− |
0.0001 |
0.001 |
0.005 |
| 日光照射日数 |
冷暗所 |
7日間 |
7日間 |
7日間 |
7日間 |
|
|
ビタミンCを添加した赤キャベツ色素溶液の耐光試験。
|
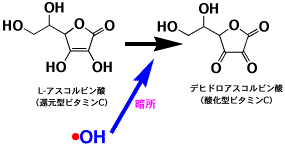
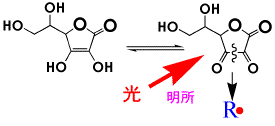
ビタミンCはL-アスコルビン酸ですが、酸化型のデヒドロアスコルビン酸になりやすいので、色素よりも速くOHラジカルと反応して、色素の酸化を抑制する働きがあります。しかし、光照射下では、デヒドロアスコルビン酸が光反応しやすい化合物であるので、優先的に反応してラジカルを発生します。このラジカルが色素と反応し、色素を脱色することになります。したがって、ビタミンCは、光の当たる場合は逆に退色を促進することになるのです。
 |
 |
|
暗所での反応
|
明所での反応
|
ルチン
同じく赤キャベツ色素を、ルチンP-10存在下で耐光試験を行った結果を次に示します。ルチンP-10を添加することで耐光性が向上し、添加量を増やすと効果も増えました。しかし、添加量が0.1%を超えると沈殿(ルチンの析出)を生じることがあります。

対照 (1) (2) (3) (4) |
| |
対照
|
(1)
|
(2)
|
(3)
|
(4)
|
| 赤キャベツ色素 |
0.001 |
0.001 |
0.001 |
0.001 |
0.00098 |
| ルチンP-10 |
− |
− |
0.0005 |
0.001 |
0.002 |
| 日光照射日数 |
冷暗所 |
11日間 |
11日間 |
11日間 |
11日間 |
|
|
ルチンP-10を添加した赤キャベツ色素溶液の耐光試験。
|
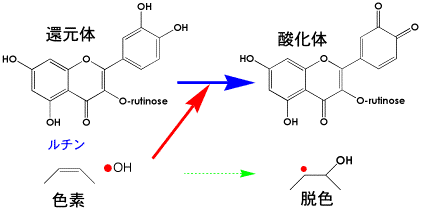
ビタミンCに比較してルチンの光反応性は低く、光照射下でも活性なラジカルと反応し、色素よりも優先するので、色素の暗所および明所での酸化抑制効果があるのです。
|
|
|
ルチンの酸化抑制反応
|
|