|
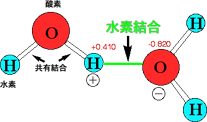
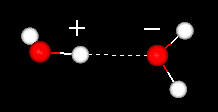
水素結合とは分子間結合の1つで、酸素−水素結合(O-H)の電子の偏りに由来する双極子相互作用の1つであることをQ 49で説明しました。この水素結合はわれわれ生物にとって非常に重要なものです。人間には多くの水が含まれ、タンパク質、核酸、脂肪、炭水化物などが含まれています。これらの物質が機能するためには、水素結合が大きな役割をしているのです。家は材木を組み立てて作られますが、材木と材木をつなぎ止めるところが水素結合であると考えられます。材木だけでは家にはなりませんが、材木をつなぎ合わせて、はじめて立体的な家ができ上がります。水素結合は、タンパク質などを立体的な形にするために必要なのです。では、生物における水素結合の重要性を見てみましょう。
 |
 |
|
水分子の水素結合
|
水と氷
人間の身体には多くの水が含まれ、植物も水を与えないと枯れてしまいます。生物にとって水は重要なものです。水があるので体温があまり変化しない、汗をかくことで体温を下げることができる、水に溶けた多くの成分を血液によって体のあちこちに運ぶことができる、など数えきれない程水の恩恵を受けています。
水にはアルコールなどと比べると、39の異常性があると言われています。生命はこの水の異常な性質に支えられているのです。例えば、
(1)高い融点、(2)高い沸点、(3)高い表面張力、(4)高い粘度、(5)大きな比熱、
(6)4℃で最も大きな比重、(7)固体(氷)になると膨張する、(8)高い誘電率、
(9)イオンの大きな溶解性、...
このような水の異常な性質は、いずれも水分子の水素結合によると考えられています。水分子は水素結合で結びついているので、融点や沸点がアルコールなどと比べて高く、粘度や表面張力が大きくなります。
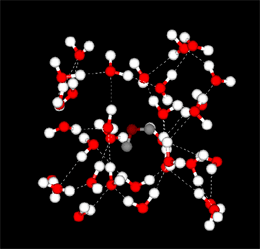
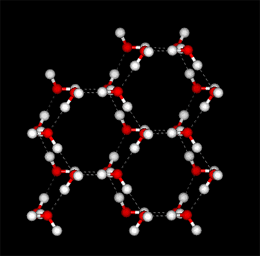
水素結合は共有結合に比べて弱いのですが、水素結合が多くあると強い力になります。水分子の水素結合は4本が可能ですが、液体の水では分子が隙間に入り込んでいるので、平均3.4本の水素結合があります。一方、氷は水の結晶で、水分子は4本の水素結合で規則正しく並んでいます。従って、隙間が出てくるために氷は水に比べて比重が低く(0.931)、水(比重=1)に浮くのです。(モデルはhttp://www.nyu.edu/pages/mathmol/から)
 |
 |
|
水(液体)のモデル(隙間がない)
|
水の結晶(氷)のモデル(隙間がある)
|
核酸
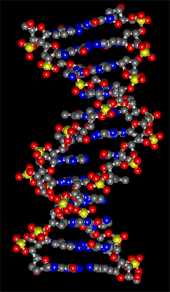
生物のいろんなタンパク質は、デオキシリボ核酸(DNA: Deoxy Nucleic Acid)にある情報によって作られます。DNAは家を作るための設計図のようなものです。ヒトのDNAは伸すと2メートルにもなる長い高分子ですが、折り畳まれたものが染色体(chromosome)で、男と女では違いますが22-23個あります。
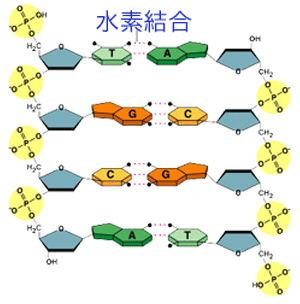
染色体のDNAは、2本の高分子が対になっていて、2重らせん構造をしています。対を作っているのは、アデニン(A)、チミン(T)、グアニン(G)、シトシン(C)の核酸塩基とよばれるものです。水の水素結合は結構でたらめですが、核酸塩基の水素結合は決まった組み合わせで作られます。アデニンはチミンと、グアニンはシトシンと図のような水素結合しています。したがって、遺伝の情報は間違えなく伝わることになるのです。
 |
 |
|
DNA二重らせんモデル
|
水素結合による塩基対の形成
|
タンパク質が合成される経路を簡単に書くと;(1)DNAの情報を読み取ってメッセンジャーリボ核酸(mRNA; Ribo Nucleic
Acid)を合成、(2)アミノ酸が結合したトランスファーRNA(t-RNA)がm-RNAの情報を読み取ってタンパク質を合成する。情報を読み取る時は、いずれも水素結合を利用して正確に読み取ります。この方式はセントラルドクマと言われますが、ウイルスにはDNAが無くてRNAしかありません。そこで、RNAからDNAを作って(逆転写)、あとはDNA→RNA→タンパク質と進みます。
タンパク質
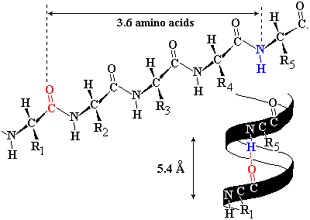
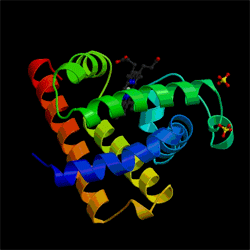
タンパク質はアミノ酸から作られていて、DNAの情報に従って合成された高分子です。タンパク質はアミド結合(-CO-NH-)からできているが、OとHの間で水素結合が形成される。一本のタンパク質のなかにも水素結合ができ、らせん構造ができる。ミオグロビン(myoglobin)は筋肉に含まれるタンパク質であるが、8本のαらせんがある。
 |
 |
|
αらせん構造
|
ミオグロビンの構造
|
また、二本のタンパク質の間でも水素結合ができる(β構造)。β構造はたくさんのタンパク質が集まることができるので大きな固まりになる。ナイロンはアミド結合をもった高分子であるが、隣の高分子とβ構造を作るので、非常に強い繊維ができる。ふつうのタンパク質はαらせん構造とβ構造をもった構造であり、水に解けるアミノ基やカルボン酸を含んでいるので、タンパク質は水にとける。しかし、β構造が多くなると、分子が集まり強いので水に解けなくなる。
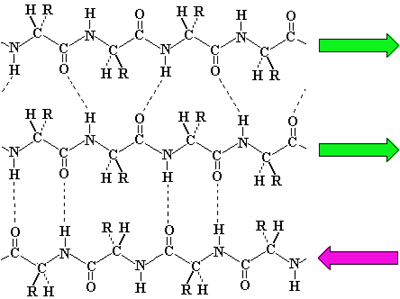 |
|
β構造(平行:緑と、逆平行:ピンクがある)
|
プリオンタンパク質
BSE(狂牛病)はイギリスで大発生し、最近日本でもBSEの牛が見つかっています。アメリカのStanley Prusiner博士(1997年ノーベル賞)は、BSEの原因はプリオン(prion)というタンパク質が原因であることを見つけました。しかし、それまで病気の原因はDNAやRNAなどを持った細菌やウイルスであったため、その考えは受け入れられませんでした。
プリオンは正常なタンパク質で脳などに存在します。このタンパク質はαらせん構造を持っています(図の左側、ピンクがαらせん構造)。BSEのもとになるプリオンタンパク質はβ構造で(図の右側、青がβ構造)、正常なタンパク質のαらせん構造をβ構造に変えてしまうのです。αらせん構造だと水に解けたり酵素によって分解し易いのですが、β構造に変化すると安定で水に溶けたり酵素により分解しなくなります。β構造は非常に安定であるので、煮ても焼いてもそれ以上変化することはありません。細菌やウイルスは熱や紫外線に弱いのですが、BSEのプリオンタンパク質は安定なので、焼却するしか方法はありません。αらせん構造も、β構造も水素結合によってできますが、鎖の中でできるか別の鎖との間でできるかで、このような違いがでてくるのです。
|
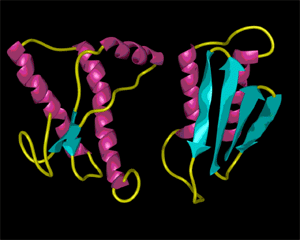
|
|
正常プリオン(左)と
β構造に変化したプリオン(右)
|
セルロース
木材や紙を作っているのは、セルロース(cellulose)という高分子です。天然のセルロースは真直ぐに伸びた高分子で、-OH基をたくさん持っています。従って、隣の分子間で水素結合ができて木材や紙のように硬い材料になります。
セルロースの単位はβ−グルコースで、デンプンのαグルコースとは違います。セルロースはβ−グルコースが1→4で直鎖状に縮合したもので、直線状の高分子です。下の図では分かりにくいですが、β−グルコース単位が交互に裏表逆に結合していますので、直線状になるのです。セルロースの分子量は,百万〜数千万にもなるといわれていますが、木綿では,β−グルコースが約3000個,パルプでは約800個結合しています。
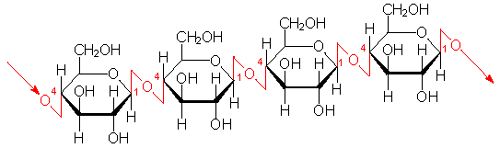 |
|
セルロースの構造
|
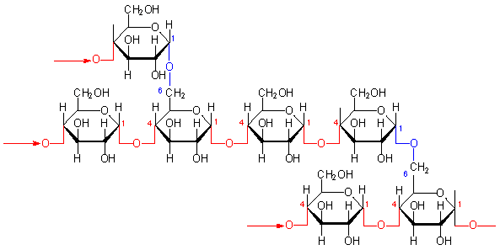
デンプン
デンプン(starch)も植物性の高分子で、構造はセルロースと似ていますが、セルロースとは異なりα−グルコースが1→4で結合しているので、真直ぐではなく曲がった高分子です。分子間で水素結合はできますが、セルロースのように連続して多くできるのではなく、部分的に水素結合ができるだけです。
デンプンはα−グルコースが100〜1000個以上結合したもので、その結合の仕方によりアミロース(amylose)とアミロペクチン(amylopectin)の2種に区別されます。したがって、デンプンは純粋なものではなく混合物です。
アミロースは、3000〜10000個のα-D-グルコースが結合(α1→4結合)した高分子の長い線状ポリマ(分子量 50 万− 200
万)です。 比較的分子量が小さく直線状であるので、70〜80℃の温水に溶けます。アミロペクチンは比較的分子量が大きく,枝分かれの多い構造(1→6結合)をもつので水には溶けません。
デンプンの検出に青紫色の呈色反応であるヨウ素デンプン反応を使いますが,アミロースがらせん構造をしていて、ヨウ素が連続してそのらせんの中に入るからです。デンプンのらせんが長くなると、無色→褐色→赤→紫→青のように変化します。これは、ヨウ素が長く連続し、青→緑→赤へと吸収が移動したからです。したがって、色は補色の、無色→褐色→赤→紫→青のように変化します。らせんの長さは、赤(3−5)、紫(6−7)、青(9−)です。
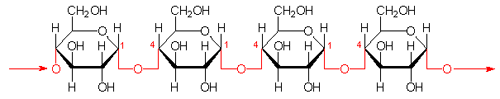 |
|
アミロースの構造
|
 |
|
アミロペクチンの構造
|
セルロース、アミロース、アミロペクチンを比較すると、分子の構造に水素結合の数が依存し、それぞれの硬さ、水への溶解性などが変わってきています。
|