|
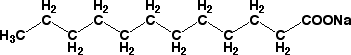
固形の石けんを考えてみます。石けんは動物や植物の脂肪酸を苛性ソーダ(NaOH)などで処理して作ったものですが、脂肪酸はミルクや大豆の成分です(ミルクと豆腐のQ&Aを見てください)。脂肪酸にはいろんなものがありますが、やし油に多く含まれているのはラウリン酸ですから、石けんは脂肪酸のナトリウム塩(ラウリン酸ナトリウム)です。ラウリン酸ナトリウムは次のような分子です。
|
|
|
|
|
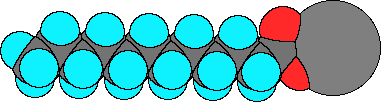
ラウリン酸ナトリウムと分子モデル
|
ラウリン酸分子は-CH2-が11個つながって最後にカルボン酸(-COOH)がありますが、そのカルボン酸がナトリウム塩になっています。炭素原子(C)をつないでいる結合(-C-C-)は共有結合です。ラウリン酸ナトリウム分子は小さいので目で見ることはできませんが、石けんは分子がたくさん集まっているので、目で見える大きさになっています。では、分子と分子をつないでいる力はなんでしょう?それが分子間力です。
|

|
|
ラウリン酸ナトリウムの会合(分子間力)
|
石けんの分子を繋いでいる分子間力はファンデルワールス(van der Waals)力ですが、分子間力にはその他イオン結合、水素結合などがあります。有機化合物はこのような分子間力によって分子が集まっているので目に見えるのです。以下に共有結合とそれぞれの分子間結合について説明します。
共有結合
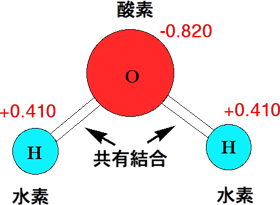
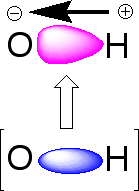
水の分子はH-O-Hですが、このH-O-の結合が共有結合です。水素(H)と酸素(O)がそれぞれ電子を1個ずつ出し合って共有し、1つの結合を作っているのです。共有結合は−で表しますが、そこには電子が2個入っています。
2個の電子は酸素と水素の間で均等に存在するのではなく、酸素が電子を引き付けて酸素側に片寄っています。それぞれの原子の極性は酸素が-0.820、水素が+0.410となっています。したがって、水分子は極性を持つことになり、食塩(NaCl)などの極性物質を溶かすことができるのです。
|
|
|
|
水分子の極性
|
電子の偏り
|
例えばポリ袋はポリエチレンですが、-CH2-CH2-CH2-CH2-とC-Cの共有結合が何十万、何百万と続いていますし、C-Hの間も共有結合です。有機化合物はほとんど共有結合からできています。このように、有機化合物は共有結合でできていて1つの分子を作っています。したがって、分子とは共有結合だけでできているものと考えていいでしょう。
分子間結合
1個の分子では、プラスチック、石けん、砂糖といった物質を作ることができません。そこで、分子をつなぎ合わせる結合(分子間結合)が必要になります。たとえば、石けんは多くの分子が集まったものです。分子と分子を結合するものには、イオン結合、双極子相互作用、ファンデルワールス力などがあります。
イオン結合
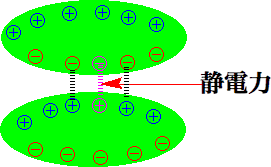
プラス(+)とマイナス(−)は静電力で引き合い、同じ符号(+と+、−と−)は反発します。磁石が引き合うようなものです。分子の中にプラスやマイナスがあると、引き合ったり反発したりします。1つの分子にプラスがあり、もう一つの分子にマイナスがあれば、分子は引き合って結合ができます。これがイオン結合です。タンパク質にはアミノ基(-NH2)を持ったアミノ酸(リジンなど)が含まれ、これが-NH3+のプラスイオンになっています。そこで、ウールや絹などのタンパク質からできている繊維の染色には、マイナス(-COO-や-SO3-など)を持った染料で染色します。すると、染料はイオン結合で繊維に結合するのです。
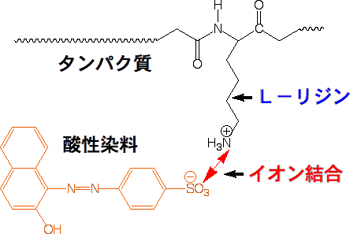 |
|
ウールや絹と酸性染料のイオン結合
|
中性分子の分子間力
電荷を持っていない中性の分子(砂糖やプラスチックなど)からなるものも固体になっていますから、分子の間には力が働いているはずです(分子間力)。このような中性分子の分子間力には、双極子−双極子相互作用とファンデルワールス力(van
der Waals)があります。
双極子−双極子相互作用
いま、X原子とY原子が共有結合で結びついているとします(X−Y)。XとYの間は共有結合で2個の電子がありますが、Xが電子を引っ張る力が強い(電気陰性度)と、電子を自分の方に引っ張っているのです。したがって、X−Yの共有結合にある2個の電子は、中間にあるのではなく、Xの方に偏っているのです。Xは中性でイオンにはなっていませんが、少しマイナスになっています(δ−と書きます)。電子を引っ張られたYは電子が少なくなって少しプラス(δ+)になっています。したがって、X−Yの共有結合はX側がマイナス、Y側がプラスに偏った結合になっているのです(双極子)。双極子はN極S極を持った磁石のようになっているので、双極子には引っ張る力(引力)と反発する力(斥力)が働くのです。
|
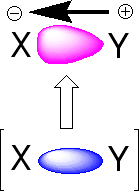
|
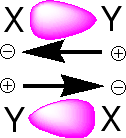
|
|
電子の偏り
|
双極子−双極子相互作用
|
水素結合
双極子−双極子相互作用の最も強い例が水素結合です。水は液体ですから、水の分子は自由に動き回っています。では、氷になるとどうして固まるのでしょう。それは、水の分子(H-O-H)の間に水素結合ができているからです。H-Oは共有結合で電子が2個入っているのですが、酸素原子は強いので(電気陰性度)電子を自分の方に引っ張っています。したがって、H-Oの共有結合にある2個の電子は、中間にあるのではなく、酸素の方に偏っているのです。H-O-Hの酸素は中性ですが、少しマイナスになっています(δ(デルタ)−と書きます)。電子を引っ張られた水素は電子が少なくなって少しプラス(δ+)になっています。イオンではないですが、δ−とδ+は引き合い、これが水素結合です。水素結合は生物にとって重要な結合で、タンパク質がらせん構造を作ったり、遺伝子DNAが情報を伝達するのに使われます。水素結合については次のQ&Aで説明します。
|
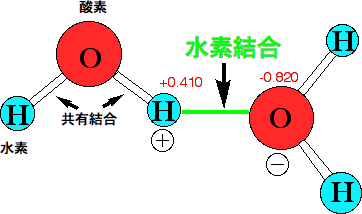
|
|
水分子の水素結合
|
ファンデルワールス(van der Waals)力
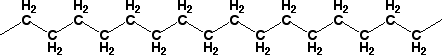
ポリ袋のポリエチレンは、-CH2-CH2-CH2-CH2-と-CH2-が長く続いたものです。ポリエチレンにはプラスやマイナスなどの電荷を持ったものも無いし、-OHもありません。したがって、ポリエチレンにはイオン結合や水素結合もありません。では、ポリエチレンはどうして固まっているのでしょう。それは-CH2-CH2-CH2-CH2-と別の-CH2-CH2-CH2-CH2-の間に、van der
Waals力が働いているからです。
|
|
|

|
|
ポリエチレンと分子間力
|
van der Waals力というのは分かりにくい力ですが、次のように考えられています。メタン(CH4)を考えると、すべて共有結合ですし炭素と水素は電子を引っ張る力が弱いので、C-Hの結合には電子の偏りはほとんど無いと考えられます。しかし、電子は動き回っているので、瞬間的には電子の偏りがあるでしょう。もし、電子が片寄ってδ−になったとすると、近くにあるCH4の結合にも電子が片寄りδ+になるでしょう。すると、δ−とδ+が引っ張りあいます。これが、van
der Waals力です。プラスチックを布で摩擦すると、プラスチックの表面はマイナスの電気を帯びます。このように絶縁体 のプラスチックの表面にたまっている静電気で、紙などの軽いものを引きつけたりする力を持っています。van
der Waals力はこのような力と考えていいでしょう。van der Waals力は小さな力ですが、-CH2-が10個あれば10倍に、1000個あれば1000倍になるので、共有結合に匹敵するような力になります。
|
|
|
van der Waals力
|
ミセル
石けんはこのように分子が分子間力で集まっているのですが、水に溶かすと分子がばらばらになって溶けるので、目には見えなくなります。しかし、石けん分子は水の中でも集まってミセルを作っています。アルキル鎖(CH2-CH2-CH2-の部分、赤い棒)は水に溶けない部分ですから集まり、水に溶けるカルボン酸のナトリウム塩(青い丸)が外に出て、水分子と分子間結合を作っているのです。ミセルの大きさは小さいのでやはり目には見えませんが、泡立たせると空気の周りに分子がたくさん並んで泡になり、白く目に見えるようになります。
シャボン玉は、空気の周りに丸い水の膜ができたものですが、カルボン酸のナトリウム塩が水の中にあり、アルキル鎖が空気中に向いています。アルキル鎖(赤い棒)の分子間力で膜が安定になっています。この膜の厚さは薄いので、光が干渉して虹色に見えます(Q&A13)。
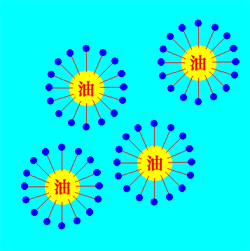
石けん水に油を入れると、油の粒子を石けん分子が取り囲み、やはりミセルを作ります。動物や植物の油は脂肪酸ですが水には溶けません。しかし、石けん分子の脂肪酸部分とは分子間相互作用をします。このようにして、石けんは油を水に溶かしているのです。ただし、本当に溶けているのではなく、目に見えないミセルを作っているのですから、溶けているように見えるだけです。溶けるとは分子が1個ずつバラバラになり周りを溶媒に囲まれている状態です。
|
|
|
せっけんが油を溶かした図
|
|