|
ルビーとサファイア
 |
 |
|
赤いルビー
|
青いサファイア
|
宝石にはいろんなものがあって、透明なダイアモンドやきれいな色が付いているものがあります。ルビーは赤、サファイヤは青です。
ルビーのほとんどは酸化アルミニウム(aluminaアルミナAl2O3)です。アルミ製の鍋に酢などを入れると、酸化されて白くなり、最後に穴があいてしまいます。この白いものが酸化アルミニウムです。
酸化アルミニウムは鉱物としては、綱玉(コランダムcorundum)と呼ばれ、赤いのがルビー(Ruby)、青いのがサファイヤ(sappire)です。酸化アルミニウムは白色で、結晶になると透明ですが、そこに不純物としてクロム(Cr:
chromium)が入ると赤に、鉄(Fe)とチタン(Ti)が入ると青になります。
Rubyはラテン語の赤ruberに由来するものです。天然のルビーは稀少ですが、アルミナにクロムを入れて合成出来るので、安価な宝石ですが、合成ルビーは赤色レーザーに用いられるので、工業的には重要な宝石です。ただし、加えるクロムの量によって、赤、赤紫、赤オレンジ、ピンクなどに色が変わってきます。
さて、白いアルミナにクロムが入るとどうして赤くなるのでしょうか?クロムは金属ですから、黒っぽい金属光沢をしています。電気ストーブやトースターにはニクロム線が使われていますが、電気を流さないと黒いものです。ニクロム線はニッケルとクロムの合金で、鉄やマンガンも入っています。
アルミナとクロムについて、その構造と色の原因について見てみましょう。クロムは鉄や銅などと同じく遷移金属ですが、アルミニウムは遷移金属ではありません。金属イオンの色については、まずQ62の「白い硫酸銅を水に溶かすと、どうして青くなるのですか?」を読んでから、このQ63に戻ってきて下さい。
アルミニウム
アルミニウム(Al: Aluminium)は、原子番号13の元素です。クロムは銅や鉄などと同じ遷移元素ですが、アルミニウムは違っています。隣にはケイ素(Si)、リン(P)などがあり、これらは金属ではありません。アルミニウムは金属ですが、非常に反応性の高い金属なのです。アルミニウムは、可視光線のほぼ99%、赤外線のほぼ95%を反射します。銀も反射率が高いのですが、酸化して黒くなるのが欠点です。反射率が高いのは、光を吸収せず、空気との屈折率が異なるためです。しかし、アルミニウムでは酸化アルミニウムの被膜ができるだけで、反射率は低下しません。このことから、ガラスの裏に塗って(蒸着)、鏡にします。反射膜、ガラスとしては現在ほとんどがアルミニウムが使われています。
 アルミニウムは軽い金属で1円硬貨に使われています。ボーキサイト鉱石(bauxite)から作りますが、ポーキサイトは酸化アルミニウムが主成分です。酸やアルカリに侵されやすいのですが、空気中では表面に酸化膜(アルマイト)ができ、内部は侵されにくくなります。 アルミニウムは軽い金属で1円硬貨に使われています。ボーキサイト鉱石(bauxite)から作りますが、ポーキサイトは酸化アルミニウムが主成分です。酸やアルカリに侵されやすいのですが、空気中では表面に酸化膜(アルマイト)ができ、内部は侵されにくくなります。
アルミニウムは両性金属で、酸にもアルカリにも溶解します。アルカリ性の水溶液では、次の反応によって水が還元されて水素を発生します。
6 OH− + 2 Al + 6 H2O → 6 OH− + 2 Al(OH)3 + 3 H2↑
生成する水酸化アルミニウム(Al(OH)3 )の溶解度は低く、ほとんど水に溶解しません。したがって、薄いアルカリでは皮膜が発生して反応が止まり、内部までは反応しません。しかし、強いアルカリ条件では水酸化アルミニウムが次式によって水溶性のアルミン酸(
[Al(OH)4(H2O)2]−)を形成するため、反応は表面のみでなく内部まで進行します。
OH− + Al(OH)3 + 2 H2O → [Al(OH)4(H2O)2]−
水酸化アルミニウムは塩化アルミニウム(AlCl3)に水を加えることでも生成します。酸性とアルカリ性では溶解し、中性ではゲル状になって析出します。このゲルを乾燥すると、部分的に脱水して酸化アルミニウムになるので、不溶となります。
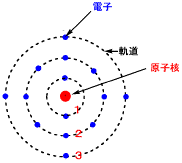
銅の場合と同じく、アルミニウム原子の軌道を見てみます。アルミニウムにはd軌道はありませんので、銅やコバルトのような色はありません。3sと3pにある3個の電子が取れやすく、+3価のアルミニウムイオン(Al3+)になります。
|
主量子数
|
副量子数
|
合計
|
|
 |
| |
s
|
p
|
13
|
|
|
1
|
↓↑ |
|
|
|
2
|
1s2 |
|
2
|
↓↑ |
↓↑ |
↓↑ |
↓↑ |
8
|
2s2 + 2p6 |
|
3
|
↓↑ |
↓ |
|
|
3
|
3s2 + 3p1 |
|
Al原子の電子配置
↓が3個抜けるとAlイオン(Al3+)になる
|
酸化アルミニウム
 |
|
Molecular Sieve , Active Alumina
|
酸化アルミニウム(Al2O3 )はアルミニウムの酸化物で、アルミナとも呼ばれます。白色の粉末で、融解塩電気分解でアルミニウムの材料となるほか、セラミックス材料にもなるので重要です。また、研削材等の高強度、高靱性、耐熱衝撃性を求められる分野や、自動車排ガス浄化触媒等の触媒の担体などに利用されています。
モレキュラーシーブ(Molecular Sieve)は、酸化アルミニウムですが、水が入れるだけの穴が空いているので、有機溶媒中の脱水に使われます。
天然には結晶が鋼玉(三方晶系)として産出するほか、水和物がボーキサイトの主成分として存在します。酸化アルミニウムではアルミニウムと酸素との結び付きは強く、ここからアルミニウムの単体を取り出すことは難しいのですが、アメリカのホール
(Charles Martin Hall) とフランスのエルー (Paul Louis Toussaint Hoult) らは電気分解を用いてこれに成功しました(ホール・エルー法)。
クロム
クロムは銀白色の金属で,酸化性の酸には不動態となり溶けません。不動態とは、金属表面に腐食に耐える酸化被膜ができることです。希酸には溶けて青色のCr2+となりますが,Cr2+は空気中で酸化されやすくCr3+になります。クロムは,不動態をつくりやすいので,めっきに用いられるほか,合金として用いられます。クロム鋼,ステンレス鋼,二クロムなどがよく知られています。ステンレス(stainless
steel、stainとは汚れ、着色などの意味です)は鉄に10%程度のクロムを含む合金で、表面にクロムの酸化被膜ができ、それ以上は錆びません。
 |
 |
|
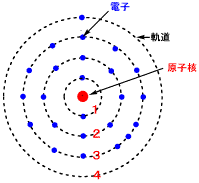
クロム原子の電子軌道
|
クロム
|
クロム原子の電子は24個で、3dに5個、4sに1個の電子が入っています。↑の電子が抜けてクロムイオンになります。1〜6個の電子が抜けて、+1〜+6までの酸化状態がとれますが、+3が最も安定な状態です。
|
主量子数
|
副量子数
|
合計
|
|
| |
s
|
p
|
d
|
24
|
|
|
1
|
↓↑ |
|
|
|
|
|
|
|
|
2
|
1s |
|
2
|
↓↑ |
↓↑ |
↓↑ |
↓↑ |
|
|
|
|
|
8
|
2s + 2p |
|
3
|
↓↑ |
↓↑ |
↓↑ |
↓↑ |
↑ |
↑ |
↑ |
↑ |
↑ |
13
|
3s + 3p + 3d |
|
4
|
↑ |
|
|
|
|
|
|
|
|
1
|
4s |
|
クロムCr原子の電子配置
|
代表的なものにクロム酸カリウムK2CrO4や二クロム酸カリウムK2Cr2O7があり,これらの6価化合物は有毒です。K2CrO4の黄色水溶液に酸を加えるとK2Cr2O7が生じて橙赤色になり,逆にK2Cr2O7の溶液に塩基を加えるとK2CrO4を生じて色が変わります。K2Cr2O7の酸性水溶液は強い酸化剤です。
|

|

|
|
K2CrO4
|
K2Cr2O7
|
|
2CrO42-(黄)+2H+→Cr2O72-(橙赤)+H2O
2CrO42-(黄)+H2O ← Cr2O72-(橙赤)+2OH-
|
クロムの化合物には、いろんなものがあり、いろんな色をしています。
|
クロムの化合物
|
|
化 学 式
|
イオン
|
色
|
溶解性
|
| Cr2O3 |
Cr3+
|
緑
|
不
|
| CrO3 |
Cr6+
|
赤
|
溶,潮解
|
| Cr(OH)3nH2O |
Cr3+
|
灰緑
|
不
|
| CrCl3 |
Cr3+
|
紫
|
不
|
| Cr2(SO4)318H2O |
Cr3+
|
青紫
|
溶
|
| Cr(NO3)39H2O |
Cr3+
|
紫
|
溶
|
| [Cr(H2O)6]Cl3 |
Cr3+
|
紫
|
溶
|
| K2CrO4 |
Cr6+
|
黄
|
溶
|
| K2Cr2O7 |
Cr6+
|
赤
|
溶
|
ルビーの赤
ルビーは酸化アルミニウムの構造で、一部のアルミニウムがクロムになっているものです。赤色はクロムの3d軌道に空きがあるからで、6個の酸素に囲まれ、3d軌道が分裂しています。水に囲まれた銅イオンの3d軌道の分裂は、緑−赤色の光のエネルギーでしたが、クロムの場合は波長が短くエネルギーの高い青−緑の光を吸収するので、赤く見えます。
サファイアの青色は鉄イオンとチタンイオンによるものですが、アルミナのAlにFeやTiが入っても、青くはなりません。これは、少し複雑な電荷移動によるもので、後日別のところで説明します。
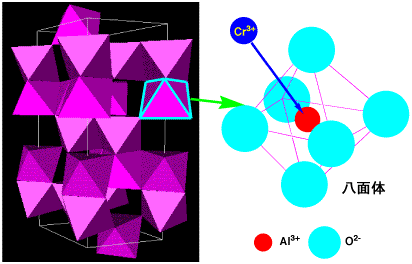 |
| α-アルミナ(Al2O3)の結晶構造 アルミニウムAl3+は6個の酸素に囲まれている。微量のCr3+(0.01〜3
mol%)がAl3+に換わるとルビーになる。 |
|