|
硫酸銅
 |
 |
|
硫酸銅溶液
|
硫酸銅結晶
|
乾燥した硫酸銅(CuSO4)は白い粉末ですが、水に溶かすと青色になります。無水物は白色粉末で,吸湿性が強く,水分を吸収して青色の水和物になるため,無水物は微量の水の検出や脱水剤に利用されます。
水を含んだ硫酸銅の青い結晶は、5個の水分子を含んだ硫酸銅(II)五水和物です:CuSO4・5H2Oまたは[Cu(H2O)4]SO4・H2O。水和物を熱すると、水和水が段階的に失われ、白色になります。
このように硫酸銅は、水に溶かしたり結晶水を含むと青色になるが、水が無いと無色(白色)となります。硫酸銅の青色は、銅イオンCu++によるもので、しかも周りに水分子が必要であることになります。銅イオンに含まれる電子が青色以外の光を吸収し、残った青色が透過・反射して人の目には青色に見えるのです。光のエネルギーを吸収するのは銅原子の電子ですが、まず銅原子の構造を見てみます。
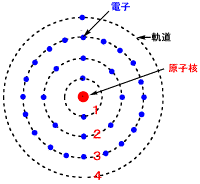
銅原子の構造
 |
|
原子の構造
|
銅Cu原子は原子番号が29ですので電子が29個あり、原子核の周りを回っています。その様子は、太陽の周りを惑星が回る太陽系のようです。地球が回る軌道には、地球が1個しかありませんが、原子の軌道には電子が2個回っています。地球は北極を上にして右回りですが、左回りの地球がもう一つ同じ軌道を回っているようなものです。(右回り、左回りをスピンといいます。)地球は太陽の引力で、軌道から離れないようになっていますが、原子では、原子核がプラス、電子がマイナスですから、静電力で結びついています。
電子の軌道はグループ分けされています。大きく1、2、3、...と分かれ、これを主量子数といいます。さらに、副量子数 s,
p, d, f,...に分かれ、軌道の形が違います。
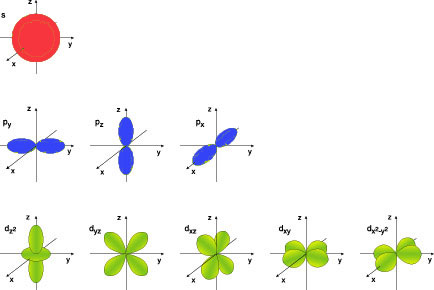
地球は大きいのでどこにいるかが分かりますが、電子は小さいので位置とエネルギー(運動量)を同時に決めることができないのです(これはハイゼンベルクの不確定性原理です)。電子は軌道を回っているのですが、位置がはっきりしません。そこで、正確には軌道は円ではなく、ぼんやりした雲になります(電子雲)。原子核に近いs軌道は球、少し遠いp軌道はダンベルのような三つの形になります。また、d軌道は2重のダンベルのようで、5つの軌道があります。
 |
|
s、p、d軌道の形
|
 |
|
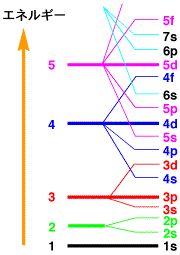
軌道のエネルギーレベル
|
原子の軌道には、電子は1個しかは入れないという、パウリの原理があります。すなわち、同じ軌道に地球が2個はいることができないということです。でも、右回りと左回りの地球は別のものですから、同時に入ることができます。原子の場合にも、↑右回りと、↓左回りの2個の電子が入れますが、それ以上は入ることができません。電子が29個ある銅原子では、近くの軌道から2個ずつ入れていきますので、29番目の電子は原子核よりも最も離れた軌道に入ります。最近、惑星ではないことになりましたが、冥王星のようですね。
上で示した惑星の軌道のような原子の構造では、1, 2, 3,..と外に行くとエネルギーが高くなりますが、軌道にはs, p, d..と形が異なりますので、複雑になります。1s,
2s, 2p, 3sでは順番にエネルギーが高くなりますが、4sでは3dよりもエネルギーは低くなります。右の図からも分かるように、さらに高くなると複雑に入り乱れてきます。大きな木を考えた場合、低い枝から出ている葉は、どの枝のものかが分かりますが、高い枝の葉はどの枝から出ているのか分からなくなるようなものです。
上のs, p, d軌道の形は、それぞれ独立して描いていますので分かりやすいですが、実際はこれらの軌道が原点を中心に重なったものですから、非常に複雑です。
電子を軌道に順番に入れていきます。副量子数は主量子数と同じ数のエネルギーレベルを持つので、銅原子の場合は、下の表のように詰まっていきます。右の図からも分かるように、3d,
4s, 4pなどはエネルギーが接近していますので、下の表は模式的なものだと考えてください。
|
主量子数
|
副量子数
|
合計
|
|
| |
s
|
p
|
d
|
29
|
|
|
1
|
↓↑
|
|
|
|
|
|
|
|
|
2
|
1s |
|
2
|
↓↑
|
↓↑
|
↓↑
|
↓↑
|
|
|
|
|
|
8
|
2s + 2p |
|
3
|
↓↑
|
↓↑
|
↓↑
|
↓↑
|
↓↑
|
↓↑
|
↓↑
|
↓↑
|
↓↑
|
18
|
3s + 3p + 3d |
|
4
|
↓ X
|
X
|
X
|
|
X
|
|
|
|
|
1
|
4s |
|
Cu原子の電子配置
↓が2個抜けると銅イオン(Cu++)になる。
銅イオンの空いている軌道(X)に配位子の電子がきて、配位結合ができる。
|
銅原子は5つの3d軌道がありますが、3つはzx面(dzx)、yz面(dyz)、xy面(dxy)に広がったクロバー状の雲です。残りの二つは少し複雑な軌道(dz2とdx2-y2)です。銅原子では5つの3d軌道に、2個ずつ10個入り、さらに4sに1個の電子が入っています。
このような銅原子で、4sにある1個の電子が取れると、Cu(I)+イオンになります。マイナスの電子が取れたので、全体としてはプラスになります(1価の銅イオン)。プラスだけでは不安定なので、普通はマイナスイオンと結合して塩になります。塩化銅Cu(I)Clは、マイナスの塩素イオン(Cl-)と塩になっています。
銅では、電子が2個(上の表で赤矢印)取れたCu(II)2+イオンになりますが、Cu(II)が安定です。硫酸銅Cu(II)SO4では、銅はCu(II)2+イオンで、これがSO42-と塩を作っています。
配位結合
銅イオンの周りに何もなければ、5つの3d軌道はエネルギー的には同じです(5重に縮退しているといいます)。この状態で光を当てても、エネルギーを吸収することはできず、透明です。水を含まない無水硫酸銅が白い理由です。
 |
|
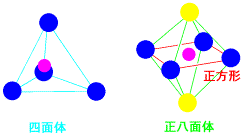
四面体、正八面体、正方形
|
硫酸銅を水に溶かしたり、結晶水になる水を吸収させると、H2Oが銅イオンの周りに配位します。H2Oの酸素原子には結合していない2つの電子(不対電子)があるので、銅の空いている4つの軌道(4s,
4p, 4p, 4d)を使って、配位子H2Oと銅イオンの間に配位結合ができます(上の表のX印)。これら4つの軌道がそれぞれ独立して配位結合ができるのではなく、4つの軌道を使って、新しく等しい4本の手ができる(混成軌道)と考えてください。したがって、4本の結合は全く同等です。
4配位で等価であれば四面体になるはずです。しかし、銅錯体の場合6配位の姿が残っているのです。正八面体の4つに、正方形に配位して、上下に配位する場所が残っています。下で述べますが、アンモニアNH3は、この上下にも配位して6配位錯体ができます。
水が配位した場合、H2Oは中性ですので、銅イオンの電荷は変わりません。銅に水が配位した錯イオン、[Cu(H2O)4]2+、と硫酸イオン、SO42-、が対になって中性の塩(錯塩)ができます。
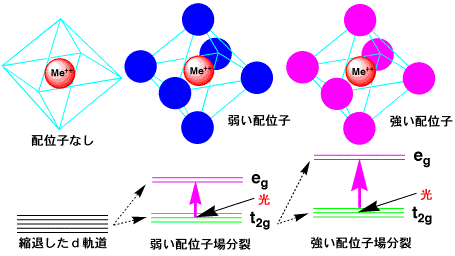
配位子場分裂
銅錯体は4配位が安定ですが、ほかの遷移金属では6配位が一般的です。立体的に衝突せずに配位するのには6個配位して正八面体となります。H2Oには原子核や電子があるので、その極性場を受けますので、5個の3d軌道のエネルギーが異なってきます。配位子による場の影響で、3重に縮退したt2g軌道と、2重に縮退したeg軌道に分裂し、これを配位子場分裂といいます。
 |
|
金属イオン(Me)と錯体
|
ここで、もう一度3d軌道を見てみます。dzy、dyz、dxy軌道は、x, y, z軸の間にあります。一方、dz2、dx2-y2軌道は、それぞれz軸、x,
y軸に向かっています。配位子は正八面体の六つの角にあり、x, y, zの方向は八面体の隅に向かっています。したがって、配位子の方向に電子の存在確率が高いdx2-y2軌道、dz2軌道は配位子による静電反発のため、軌道のエネルギーが押し上げられ、2重に縮退したeg軌道になります。また、配位子の方向に電子の存在確率が低いdxy軌道、dyz軌道、dzx軌道はエネルギーが低く、3重に縮退したt2g軌道になるのです。
eg軌道に空きがある場合、分裂幅に応じた光を吸収することにより、t2g軌道の電子はeg軌道に遷移し、人間の目には吸収される光の波長の補色にあたる色が見えるようになります。硫酸銅CuSO4では、銅原子の3d軌道から電子が1個なくなっているので、eg軌道に1個の空きがあります。光を当てると、t2gにある電子は、eg
- t2gに相当する光のエネルギーを吸収してegに上ります。硫酸銅ではeg - t2gに相当するのは、緑から赤にかけての光なので、この光を吸収します。したがって、吸収しない青の光は反射したり透過したりして青く見えるのです。
分光化学系列
d軌道の分裂の大きさは同じ価数であっても配位子の種類によって異なります。水のような弱い配位子に比べ、強い配位子が近付くと、分裂は大きくなります。分裂が大きいとエネルギーは大きく、吸収する光の波長は短くなります。
従って、配位子の強さによって金属イオンの色が変化することになり、これを分光化学系列といいます。
配位子の強さの順に並べると、次のようになります。
I- < Br- < S2- < SCN- < Cl- < N3-,
F-< OH- < ox < H2O < NCS- < py, NH3 <
en < bpy, phen < NO2- < CN- < CO.
ox: oxalate, py: pyridine, en: ethylenediamine, bipy: 2,2'-bBipyridine, phen: 1,10-phenanthroline
配位子が異なるCo(III)錯体の色は右の写真です。 |

(a) CN-, (b)NO2-, (c)phen, (d)en, (e)NH3, (f)gly, (g)H2O,
(h)OX2-, (i)CO32- Adam R. Riordan, et. al  |
遷移金属
原子の性質を考えて表にしたものが周期律表です。真ん中の青い部分が遷移元素で、特に、21番のスカンジウム(Sc)から30番の亜鉛(Zn)までを第1遷移元素といいます。遷移金属のイオンではd軌道が電子で詰まっていないので、光によって電子がエネルギーの高い状態(励起状態)になります。吸収される光の波長は中心の遷移金属や配位子の種類によって異なってきますが、遷移金属イオンではちょうど可視光線の範囲なので、いろんな色になります。例えば、塩化コバルト(II)(Co(H2O)6Cl)は鮮やかなピンク色をしています。
|
金属イオン
|
d電子数
|
配位数
|
立体構造
|
例
|
色
|
|
Cr3+
|
3
|
6
|
正八面体
|
[Cr(NH3)6]3+
|
黄
|
|
Fe2+
|
6
|
6
|
正八面体
|
[Fe(CN)6]4-
|
黄
|
|
Fe3+
|
5
|
6
|
正八面体
|
[Fe(CN)6]3-
|
赤褐
|
|
Co2+
|
7
|
6
|
正八面体
|
[Co(NH3)6]2+
|
淡赤
|
|
Co3+
|
6
|
6
|
正八面体
|
[Co(NH3)6]3+
|
黄赤
|
|
Ni2+
|
8
|
6
|
正八面体
|
[Ni(NH3)6]2+
|
青紫
|
|
Pt4+
|
6
|
6
|
正八面体
|
[PtCl6]2-
|
黄
|
|
Cu2+
|
9
|
4
|
正方形
|
[Cu(NH3)4]2+
|
深青
|
|
Ag+
|
10
|
2
|
直線形
|
[Ag(NH3)2]+
|
無
|
|
Au3+
|
8
|
4
|
正方形
|
[AuCl4]−
|
黄
|
アンミン錯体
青い硫酸銅水溶液にアンモニア水を加えると、水酸化銅ができるが、中性であるので水への溶解度が低く白い沈殿ができます。これは、アンモニア水のOH-が銅イオンに配位したためです。
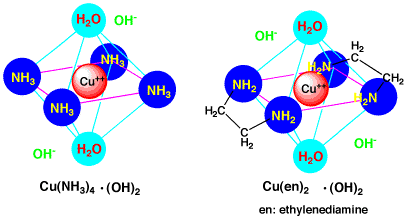
さらにアンモニア水を加えたり濃くすると、白い沈殿は溶けて、青い水溶液になり、青い結晶ができる時もあります。これは、銅にアンモニアNH3が配位した青い銅アンミン錯体であるCu2+(NH3)4(OH-)2ができたためです。銅アンミン錯体では、NH3は平面4配位で強く結合しますが、上下には水が弱く配位しています。また、この錯体はプラスですから、その外側にマイナスのOH-が存在しています。
さらに濃いアンモニア水を加えるか、エタノールを少し加えると、過剰のアンモニアが銅に配位して6配位となり、深い青色になります。
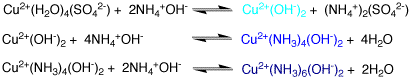
この反応は平衡で、水で薄めるとアンモニアは容易に離れます。銅の配位子は強く結合しているのではなく、付いたり離れたりしているためで(置換活性といいます)、アンモニアと水は速く置き換わっています。
1分子に2つのアミンがあるエチレンジアミン(en: ethylenediamine)を用いると、アミンが離れるのが遅れるので、より安定な錯体ができます(キレート効果といいます)。
 |
|
銅アンミン錯体
|
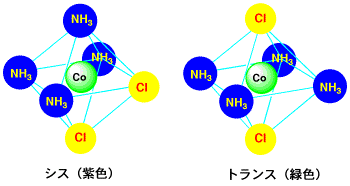
銅の配位子はすぐに置き換わりますが、コバルトでは一度結合すると安定で、簡単には離れません。テトラアンミンコバルト(III)塩化物、[Co(NH3)4Cl2]+、では、そのため異性体ができます。下の構造では、上下の配位子は水平面の配位子と位置が違うように見えますが、6つの配位子の位置は全て等価です。このような異性体では、配位子の立体的な構造が中心の金属に与える影響が異なるので、錯体の色が異なってきます。
 |
|
コバルト錯体の異性体
|
|