紫外可視吸収スペクトル
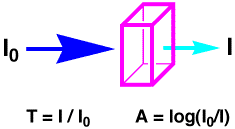 |
|
吸収スペクトルの測定
|
トマトが赤いのは、青と緑の光を吸収して赤の光を反射するからでした。ところで、光を吸収するとはどういうことでしょうか。このことを理解するためには、紫外可視吸収スペクトル(UV-VIS
Spectra)を測定する必要があります。
色素を水に溶かして透明な容器(石英セル)に入れ、光を当てて反対側に出てくる光の強さを測ります。当てた光の強さがI0で、出てきた光の強さがIだったとします。吸収された光の量は、透過率(T:
transmittance)では、T = I / I0になりますが、一般には対数をとって吸光度(A:
absorbance)で表します (A= log I0/I)。 |
 |
|
吸収スペクトルの例
|
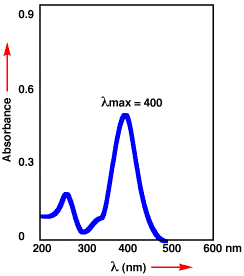
吸収が無ければ、透過率100%(T = 1.0)で吸光度は0(A = 0)になります。透過率が1%(T = 0.001)の時は、吸光度は2(A
= 2)になります。当てる光の波長を変化させ、波長に対して吸光度をプロットしたものが、右の図のような吸収スペクトルになります。山の頂上の波長が最大吸収波長で、λmaxで示します。
溶かす色素の量(グラム→モル)を正確に測っておくと、溶液(1リットル)の濃度が求まります(c = mol / l)。モル吸光係数(ε)が次の式で求まります:ε
= A / cd (ここで、dは測定した透明容器(石英セル)の長さです)。例えば、分子量500の色素を0.05グラム測り1リットルの水に溶かすと、濃度(c)
= 0.0001 = 1 x10-4 Mになります。1 cmの容器(d = 1)を用いて測定した時のλmaxでの吸光度(A)が1だとすると、分子吸光係数(ε)
= A / cd = 10,000 になります。(Q15の色価の所にも同じ説明があります。)εの値は大きいので、普通、logεを使います。
光を照射していない場合、分子にある電子は基底状態にあって、低いエネルギー状態の軌道にいます。光を照射すると、電子は光のエネルギーを吸収して高いエネルギー状態の軌道(励起状態)に移ります。このエネルギーの差が吸収波長(λ)に相当します。可視光線では36〜72
kcal/moleで、200 nm以下の近紫外領域では143 kcal/moleにもなります。200 nm以下では、空気に含まれる酸素や炭酸ガスが光を吸収してしまいますので、測定は困難です。 |
 |
CH2=CH2 π*2
|
|
CH2=CH2 π1
|
|
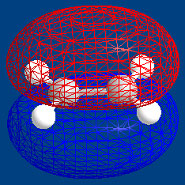
エチレンの軌道
|
エチレンの分子軌道
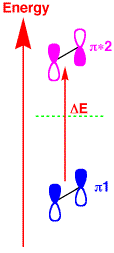
Q-60で分子の軌道について述べましたので、電子の軌道で基底状態、励起状態を考えてみます。 エチレン(CH2=CH2)にはp軌道が二つあり、p軌道はプラスとマイナスがあります。2つのp軌道が同じ方向に向いているもの(π1)と、反対方向に向いているもの(π*2)があります。同じ方向に向いているとp軌道の重なりができるので、安定になります。逆の方向ではp軌道の重なりが無く不安定になります。
光を照射していない時には電子は青の規定状態にいます。光を照射すると、電子は光のエネルギーを吸収して、一つの電子は赤の高いエネルギー状態の励起状態になります。p軌道には電子は2つありますので、1つの電子は低い青の軌道にいます。
赤の高いエネルギー状態のモデルは右の図のようにp軌道間に重なりはありませんが、下のモデルでは、軌道が重なっています。このような軌道はChem3D
Ver 9(http://www.cambridgesoft.com/)を使うと、簡単に描くことができます。
このことは、光を吸収して励起状態になると、π結合が切れてしまうことになります。しかし、π結合が吸収する光の波長ではσ結合は吸収しないので、そのまま残っているので、励起状態から基底状態に戻れば、もとのエチレンになります。 |
 |

CH2=CH-CH=CH2 LUMO
π*3
|
|
CH2=CH-CH=CH2 HOMO
π2
|
|
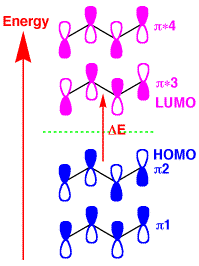
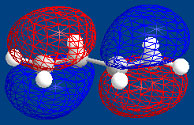
ブタジエンの軌道
|
ブタジエンの分子軌道
ブタジエンになると、p軌道が4つになり電子も4つになります。p軌道の方向で組み合わせを考えると4種類あることがわかります。下の青の軌道(π1、π2)は、少なくとも2つの軌道が重なりますが、上の赤い軌道(π*3、π*4)では、重なりが無く不安定だということが分かります。
光を照射しないと、4つの電子は青の下側の軌道にいますが、光を当てるとエネルギーを吸収して赤の励起状態に上がります。電子が上に励起される時は、青の軌道でエネルギーの高い上側の軌道(π2)から、赤の下側の軌道(π*3)に上がります。基底状態や励起状態の電子の軌道はいろいろありますが、基底状態の一番高いエネルギー状態(π2)を最高占有分子軌道(highest occupied molecular orbital (HOMO))といい、励起状態の一番低いエネルギー状態(π*3)を最低非占有分子軌道(lowest
unoccupied molecular orbital (LUMO))といいます。すなわち、光励起はHOMOからLUMOに励起されます。HOMO、LUMOは、ノーベル賞を受賞された福井謙一先生が考えられました。 |
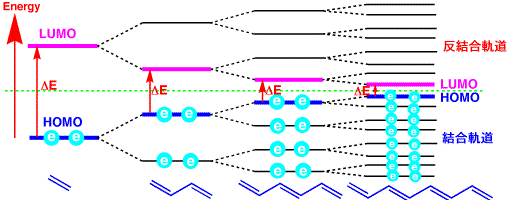
ポリエンの吸収スペクトル
エチレン、ブタジエンとポリエンが長くなると、λmaxは長波長にシフトします。二重結合が1つ増えるとほぼ30 nmシフトしていきます。この理由を考えるためにエネルギーレベルを見てみましょう。エチレンでは2つのp電子がπ分子軌道にあります。ブタジエンになると、4つのp原子軌道から4つのπ分子軌道ができます。2つは結合軌道(bonding)で、2つは反結合軌道(antibonding)です。同様にして二重結合が3つのトリエンになると、6つの電子のための軌道が必要になります。このように二重結合の数が増えると、多くの軌道が結合性、反結合性ともに増えてきます。すると、エネルギーの幅がでてくるので、HOMOは高く、LUMOは低くなってきます。光のエネルギーを吸収する励起はHOMOからLUMOへ起こりますから、二重結合の数が増えるとHOMOとLUMOのエネルギー差(ΔE)、すなわち吸収のエネルギーが小さくなり、光の波長では長波長に移動するのです。最後にはエネルギー差が無くなり、金属のように電子は自由に移動できるようになるでしょう。
まとめると、共役系が長くなると結合性π分子軌道の数が増え、エネルギーの高い不安定なものも増えてきて、それがHOMOになります。また、反結合性π分子軌道の数も増え、その中にはエネルギーの低い安定なものができ、それがLUMOになります。二本の木を庭に離して植えたのに、大きくなって木の枝が接近してしまったようなものです。 |
|
|
|
|
ポリエンの基底状態と励起状態
|
|
| レチナール、カロテン、リコペンと共役が長くなると吸収の波長が長くなる理由が分かったと思います。 |