|
フラバノールとアントシアニジン
 |
| アカダイコン色素 |
フラバノールはフラビン系の化合物で、緑茶に含まれる無色のカテキンです。なお、緑茶の緑はクロロフィルによるものです。フラバノールの吸収スペクトルは、257, 289, 298 nmで、可視部には吸収がないので溶液は無色です。一方、アントシアニジン(アントシアニンの糖を含まないもの)もフラビン系の化合物で花などに含まれる色素ですが、例えばアカダイコン色素は写真のような鮮やかな赤色をしています。この色素はアントシアニンであるペラルゴニジン(pelargonidin)で、265, 280, 430, 505 nmに吸収があります。
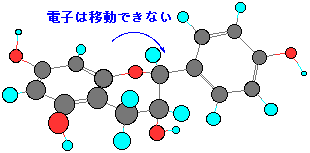
下の図にあるフラバノールの分子モデルで、真中の酸素を含んだ6員環では二重結合がなく平面ではありません。したがって、左のベンゼン環の電子は、真中の6員環には移動できません。
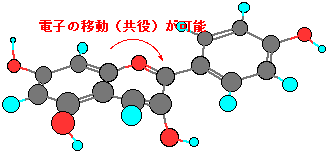
一方、アントシアニジンでは、真中の酸素がある6員環には二重結合が2つあります。したがって、アントシアニジンでは電子の動ける範囲が真中の酸素がある6員環まで広がるので、波長の長い光(緑の光)を吸収して、アントシアニンの赤い色になるのです。
酸素原子は6個の電子があるので、水の分子(H-O-H)では酸素には結合に使われない電子が2個あって、それはp軌道にあります。この電子1個を使って、炭素との間で二重結合を作ることができます。このような二重結合(−O=C−)を作ると、形式上、酸素の電子が1個不足することになるので、酸素はプラス(−O+=C−)になるのです。この説明はすこし難しいと思いますので、次に単純な系で構造と光の吸収を説明します。
|
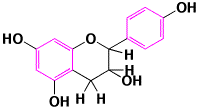
フラバノール
|
|
|
電子が移動できるのはベンゼン環だけで、隣の6員環へは移動できない。
|
|
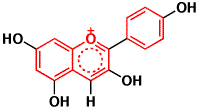
アントシアニジン
|
|
|
電子はベンゼン環から隣の6員環へも移動できる。
−O=C−になると、酸素に電子が足りなくなり、プラスになる。
|
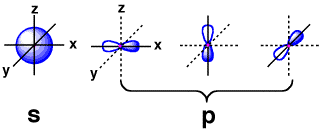
原子の軌道
 |
|
原子軌道の種類例
|
分子には電子があり、その電子が光のエネルギーを吸収します。電子が動き回っている道である軌道とはどのようなものでしょう。軌道を知るためには、量子力学、分子軌道法など物理の難しい勉強が必要ですが、ここでは簡単に絵で説明します。
マイナスの電子はプラスの原子核の周りを運動していますが、シュレ−ディンガ−(Erwin
Schrodinger)は電子の運動を電子のエネルギーで数学的に表現し、波動方程式を作りました。原子核の周りを回る電子は、太陽の周りを回る地球のようですが、電子のような微粒子には不確定性原理があって位置とエネルギーを同時に決めることはできません(ハイゼンベルグ)。例えば、絶対零度になっても、電子の位置を決めることはできず、動いているのです(アインシュタイン)。
そこで、電子の存在するような場所を雲のように描いたのが(電子雲)、原子軌道です。最も安定(最低エネルギー準位)なのは1s軌道で、原子核が中心にある球の形をしています。原子の近くを回っているので、マイナスの電子はプラスの原子核の影響を受けます。1s軌道よりもエネルギーが高く不安定なのは2s軌道で、1s軌道よりも大きな球です。次にエネルギーが高いのは2p軌道で、等しいエネルギーを持つ3つの軌道です。p軌道はひょうたん型ですので、原子核の影響は少なくなります。
分子の軌道(σ軌道とπ軌道)
エタンのC-C結合は、2sと2p軌道を使って作られ、σ(シグマ)軌道といいます。炭素の持っている電子は6個で、1s(2),
2s(2), 2p(2)ですが、2sと 2pの3個の軌道を使って4個の軌道が作られ(sp3混成)、水素や炭素などと4本で結合します。この軌道は炭素原子の近くにありますので、この結合は強く、切断するには高いエネルギーが必要です。
エチレンは二重結合で結ばれていますが、その内の1つはシグマ結合で、もう1つはπ(パイ)結合です。エチレンのσ結合は、2sと2pの2個から3本の手が作られます(sp2混成)。もう1個電子が余っていますが、これは使っていないp軌道にいます。p軌道はひょうたん型ですが、隣の炭素のp軌道と重なり新しい結合ができます。この結合はσ結合とは形も違いますので、π結合とよびます。このように、エチレンは強いσ結合と弱いπ結合からできているのです。
|
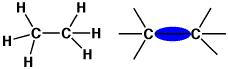
|
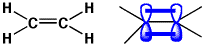
|
|
|
|
|
エタン(炭素原子はσ結合で結び付いる)
|
エチレン(σ結合とπ結合で結び付いている)
|
σ結合の電子も光を吸収しますが、強い結合で安定ですから、波長が短くエネルギーの高い紫外線が必要です。π結合の電子は原子核から離れていて、自由に動けるので、少しのエネルギーで動けます。しかし、エチレンでは波長の短い紫外線が必要です。
レチナール、カロテン、リコピン
連続した二重結合の長さが異なる、レチナール(ビタミンA)、ニンジンに含まれるカロテン、トマトリコピンの構造と色の違いを見てみます(ここでは簡単のため主鎖だけ示して側鎖の-CH3や末端の構造は省略してあります)。
レチナールは二重結合が4個で炭素原子8個に渡ってπ電子が移動できます。このような-C=C−C-二重結合が1つおきにあるような構造をポリエン(polyene)といいます(ethyleneのeneです)。ポリエンでは、それぞれの炭素にはp軌道があるので、電子は連続して動くことができます。どの程度のエネルギーを吸収するかは、紫外可視吸収スペクトルを測定すると分かります(照射する光の波長を変えて、どの波長の光を吸収するかを測定します)。レチナールの紫外可視吸収スペクトル(UV-VIS)は365
nmで、溶液にすると透明です。二重結合があると光を吸収しているのですが、人間の目には見えない紫外線の光なので、透明なのです。
オレンジ色のニンジンのカロテンは二重結合が9つありますので、電子は長い距離を動くことができます。カロテンに光を照射すると、電子は光のエネルギーを吸収して高いエネルギー状態(励起状態)になります。カロテンではレチナールに比べて電子は長い距離を動けるので、低いエネルギーでも吸収します。レチナールの吸収スペクトルは365
nmですが、カロテンでは466 nmの波長の光を吸収します。光の波長とエネルギーは逆数の関係があるので、カロテンはレチナールに比べて小さなエネルギー(長い波長の光)で励起状態になります(青の矢印)。
赤いトマトにはリコピンが含まれていて、二重結合は11個ある化合物です。電子の動ける距離はカロテンよりも長くなり、500
nmの長い波長の光でも吸収するようになります(緑の矢印)。
電子の動ける距離が長いと励起に必要なエネルギーが小さくなる理由は、 別のページに書きます。
|
ポリエン構造を有する3種の化合物の化学式と分子モデル
|
|
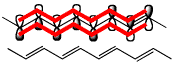
|
|
|
レチナール(UV-VIS: 365 nm)
|
|
|
|

カロテン(UV-VIS: 466 nm)
|
|
|
|

リコピン(UV-VIS: 500 nm)
|
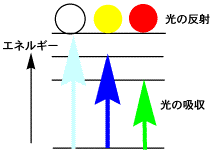
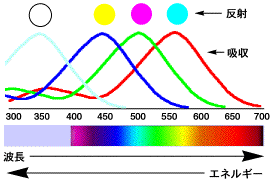
レチナール、カロテン、リコピンのUV-VISスペクトルを比較すると左下のようになります(この図は模式図です)。レチナールは水色の線で、350
nm付近に山があります。この図で縦軸は吸収する光の量を示していて、高い山は多くの光を吸収します。レチナールが吸収する光の波長は紫外線の領域にあり、人間の目には見えない光ですから透明です。もしレチナールの固まりがあったとすると、赤、緑、青の光は吸収しないので、全ての波長の可視光線を反射して、白く見えるはずです。
カロテンの吸収スペクトルは下の図の青い曲線のように、450 nm付近に山があります。赤や緑の光は吸収しませんから、反射して黄色に見えます。
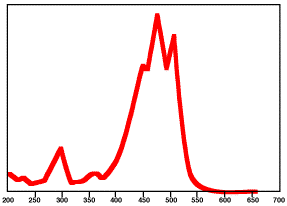
トマトリコピンのUV-VISスペクトルは緑の曲線のようになります。緑を吸収するので、赤と青の光が反射してマゼンダの光になります。それでは、トマトの赤色にはなりません。左下の図は単純な模式図ですが、実際のスペクトルは右下のように山が3つあって、左下の青と緑の曲線を合わせたようなものです。したがって、青と緑の光を吸収し赤の光を反射するので、トマトは赤く見えるのです。
左下の図で赤の曲線は570 nm付近に吸収の山がありますので、赤の光を吸収して青と緑の光を反射するので、青く見える物質です。
|
|
 |
|
吸収スペクトルと反射する光の色
|
リコピンの吸収スペクトル
|
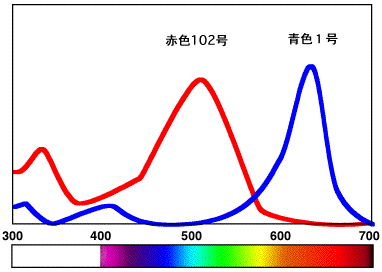
天然の花では青色のものは少ないのですが、合成の色素には青色があります。合成食用色素の赤色102号と青色1号の吸収スペクトルを比較すると、下の図のようになります。赤色102号の吸収スペクトルは500
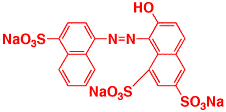
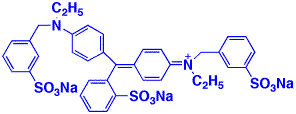
nm付近に山があるリコピンに似ています。一方、青色1号の吸収スペクトルは650 nm付近に山があるもので、青い光の波長付近の吸収が無いので、この色素は青色になります。下の構造式では曲げて書いてありますが、電子が動ける二重結合の部分が長く、赤の光を吸収することが分かります。
|
|
|
食用色素:赤色102号と青色1号の吸収スペクトル
|
 |
 |
|
赤色102号
|
青色1号
|
図には示していませんが、青、緑、赤の全ての波長の光を吸収すると、反射する光がありませんから、黒になります。ノーベル賞を受賞された白川先生の研究はポリアセチレンですが、リコピンよりももっと多く二重結合が伸びたものです。リコピンもそうですが、このような化合物では、真直ぐ伸びた構造は不安定なので、あちこち折れ曲がった構造が沢山できます。このことは、波長の短い光から長い光まで色んな波長の光を吸収することになります。したがって、ポリアセチレンは黒いのです。
|