|
指示薬とは溶液のpHにより色が変わるもので、酸ー塩基指示薬(acid-base indicators)といいます。フェノールフタレインやリトマス試験紙などよく知られたものがありますが、天然の紫キャベツなどのアントシアニン系色素も使えます。
色が変わるpHは、指示薬によって異なりますので、どのpH変化を見たいかによって指示薬を選びます。一般的な指示薬と色の変わるpHを次の表にまとめてあります。
 |
|
指示薬と変色するpH
|
それぞれの指示薬について、化学構造とpHによる変化を示します。色が変わるのは、酸性ではH+、アルカリ性ではOH-により色素が反応して構造が変わるためです。以下、pHによる順に説明しますが、補足説明では、構造による分類を示しています。
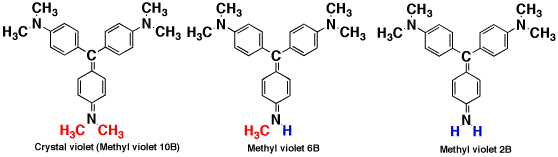
メチルバイオレット(Methyl violet)

性質:グリーンの粉末。溶解性;水(25℃) 50 g/l 、アルコール 60 g/l 。融点;137℃(分解)。Merck
Index 11 , 4287。UV: λ max. ABS in C2H5OH 50% 583-587 nm
ベンゼン環にアミン(NH2)が付いたものはアニリンですが、そのアミノ基にメチル基(CH3-)が2つ付いたものはジメチルアニリンです。このジメチルアニリン3つが1つの炭素(C)に付くと紫色の色素であるクリスタルバイオレット(crystal
violet)になります。クリスタルバイオレットにはメチル基が6つありますが、メチル基が5つ、4つのものがメチルバイオレットで指示薬に使われます。メチル基4つのものはメチルバイオレット2B、5つのものはメチルバイオレット6B、クリスタルバイオレットはメチルバイオレット10Bともいいます。メチルバイオレットは5メチル置換体が主成分で、4置換体と6置換体が混じっています。
メチルバイオレットの水溶液に塩酸(HCl)を加えると、窒素(N)に塩酸のプロトンが付いてカチオン(プラスイオン)になります。この液に苛性ソーダ(水酸化ナトリウム、NaOH)を加えていくと、Nに付いたH+とNaOHのOH-が反応して水(H2O)になり、メチルバイオレットは中性の(電荷を持たない)ものになります。Nに付いていたHがはずれたので解離といいます。この反応は平衡反応なので、再び塩酸を加えると元のNにH
が付いたカチオン型になります。この平衡定数を解離定数(Kb)といい、pHと同じく逆対数でpKbで表します。また、逆にNにHが付く逆反応は結合定数(Ka)で,pKaで表します。
メチルバイオレットのpKaは0.8で、pHが0.8でNにHが半分付いた状態です。メチルバイオレットの色が変わるpH は、このpKaのpH
の時なのです。メチルバイレットはpHが0.0-1.6で色が変わりますが、その中間がpKa のpH 0.8なのです。-N(CH3)2に付いたHがはずれるのは、もっとアルカリ側でpH 9.5付近です。
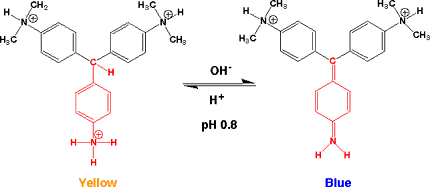
メチルバイオレットはpH 0では黄色ですが、pH 1.6では青になります。どうして色が変わるのかを考えてみます。強い酸性ではH+が窒素(N)に付き3つのベンゼン環が自由に回転することができ、1つのベンゼン環の電子が他のベンゼン環に移動できないので共役が短くなります。したがって、ジメチルアニリンのいろの黄色になるのです。
pHが1.6よりも高くなると、窒素に付いていたプロトンがはずれ、電子が3つのベンゼン環で自由に動き回れ、共役が延びるので、波長の長い青になります。N、ベンゼン環、C
の間が二重結合になり、ベンゼン環の二重結合の位置も変化しています。電子が動き回れる二重結合が長くなると、吸収する光の波長が長くなることは以前のQ&Aで述べました。しかし、この構造では赤を吸収するほどは二重結合は長くないので、青なのです。
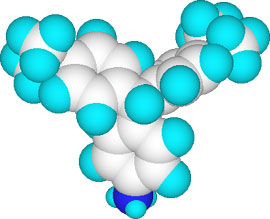
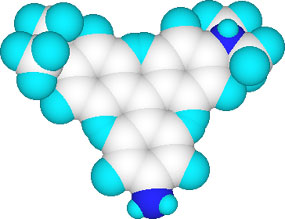
2つの構造でベンゼン環の位置が異なっているのは3Dの分子モデルで見るとよく分かります。酸性ではベンゼン環は直交していますが、中性では3つのベンゼン環は水平に並んでいます。
 |
 |
|
pH 0.8以下での3Dモデル
|
pH 0.8以上での3Dモデル
|
チモールブルー(Thymol Blue)
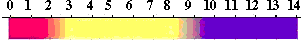
性質:ダークグリーンの粉末。溶解性;水(20℃) 0.6 g/l 、アルコール 70 g/l 。融点;224℃(分解)。Merck
Index 12 , 9541。UV; λ max. ABS in NaOH 0.1 mol/l 593-597 nm。pK 1.5, 8.9。
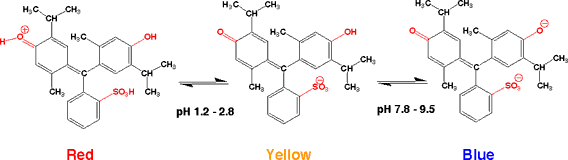
チモール(Thymol)とはハッカの仲間のタイム(Thyme)から取れる油です。チモールブルーにはこのチモールが2つ含まれています。チモールブルーは色が変わるpHが2つあり、pH 1.2 - 2.8で赤から黄色に、 pH 7.8 - 9.5 で黄色から青に変わります。チモールブルーにはNは含まれず、その代わりに-OHがありますので、メチルバイオレットとは異なった色の変化があるのです。 |
 |
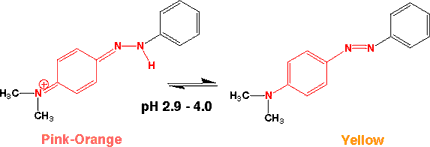
メチルイエロー(Methyl yellow)
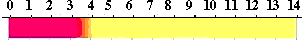
性質:オレンジからブラウンの結晶。溶解性;アルコール、ベンゼン。融点;117℃。
Merck Index 12 , 3279。UV; λ max. ABS in HCl 0.1 mol/l 508-512 nm。
ジアゾ基(-N=N-)を含む化合物で、2つのベンゼン環はつながっているように見えますが、-C=C-ではないので切れています。したがって、中性ではジメチルアニリンに由来する黄色です。
酸性(pH 2.9以下)になると、ベンゼン環とNの間に二重結合ができて、長波長の光を吸収しピンクーオレンジになります。pH
4.0では、黄色になります。
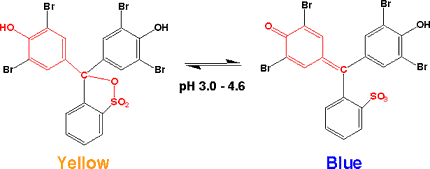
ブロモフェノールブルー(Bromophenol blue)

性質:淡いオレンジの粉末。溶解性;水(20℃) 3 g/l 、アルコール 9 g/l 。融点;273℃。Merck
Index 12 , 1468。UV; λ1 of max. ABS at pH 3.0 434-439 nm、λ2 of max. ABS at pH 4.6 590-593 nm。pK 4.0。
酸性ではグリーンがかった黄色で、pH 3.0から4.6にかけて変色し、中性、アルカリでは青である。
酸性側では環状スルホンになっていて、3つのベンゼン環に電子の流れはなく、長波長の吸収はありません。中性ではスルホン環が開き、フェノールはキノン型となって、青くなります。
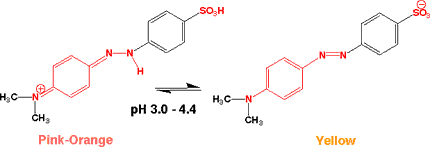
メチルオレンジ(Methyl orange)

性質:オレンジの粉末。溶解性;水(20℃) 5.2 g/l 、アルコール 0.8 g/l 。Merck Index 12
, 6180。UV; λ of max. ABS in HCl 0.005 mol/l 505-508 nm。
酸性ではピンクーオレンジで、pH 3.2から4.4にかけて変色し、中性、アルカリでは黄色になります。
メチルイエローと同じくジアゾ基(-N=N-)を含む化合物で、片方のベンゼン環にスルホン基が付いています。
酸性(pH 3.2以下)になると、ベンゼン環とNの間に二重結合ができて、長波長の光を吸収しピンクーオレンジになります。
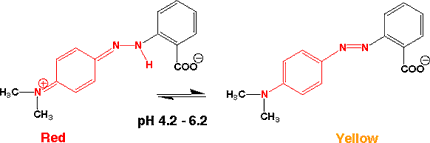
メチルレッド(Methyl red)
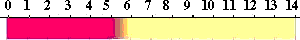
性質:赤または紫の結晶。溶解性;ベンゼン可溶、水(20℃) 0.1 g/l 、アルコール 2 g/l 。融点;179℃。Merck
Index 12 , 6199。UV; λ1 of max. ABS at pH 4.2 525-528 nm、λ2 of max. ABS at pH 6.2 430-434 nm。
酸性で赤、pH 4.2から6.2で変色し、中性、アルカリ性では黄色になります。
メチルレッドの構造は上のメチルオレンジとよく似ていて、-SO3Hが-COOHに変わっただけです。色の変わる領域は、pH
4.2 - 6.2ですが、ベンゼン環に付いている-COOHの影響でプロトンが付きにくくなっています。また、色もさらに波長の長い赤になります。
リトマス(Litmus)
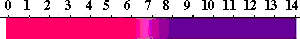
性質:ダークブルーの粉末。溶解性;水(20℃) 50 g/l 、アルコール 3 g/l 。Merck Index
12 , 5574。UV; λ1 of max. ABS at pH 5.0 498-504 nm、λ2 of max. ABS at pH 8.0 580-585 nm。
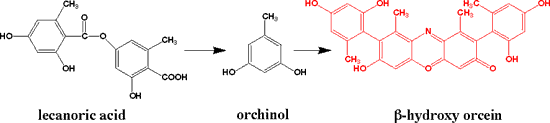
リトマスは地衣類の色素で、何種類かの混合物です。
コケに含まれる成分(何種類かがありますが、たとえばレカノリン酸、lecanoric acid)を加水分解してオルシノール(orcinol)にします。これをアンモニア存在下で空気酸化してフェノキサン(phenoxanone )誘導体であるオルセイン(orcein)にします。オルセインにはいろんな誘導体がありますが、βーヒドロキシオルセイン(β-hydroxy
orcein)もその一つです。ちょうど、お茶のカテキンが重合してタンニンができるのと似ています。さらにアルカリ条件で酸化すると重合が起こりリトマスになります。
リトマスは16世紀にオランダで作られましたが、今はイタリア、フランス、イギリスでもいろんなコケから作られています。しかし、リトマスの作り方は企業秘密で、詳しいことは分かっていません。
青リトマス紙はリトマスの濃い液に紙を浸して作ります。酸性で赤くなり、アルカリ性では青のままです。赤リトマス紙は青リトマス紙を希薄な塩酸や酢酸に浸けて作ります。アルカリ性で青くなります。
酸性では赤で、pH 4.5から8.3にかけて変色し、アルカリ性では青になります。酸性ではフェノキサン環のN にプロトンが付いていると考えられます。
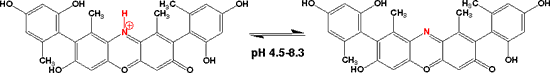
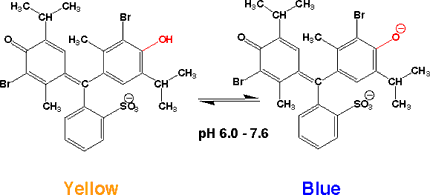
ブロモチモールブルー(BromoThymol Blue, BTB)
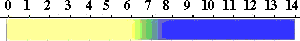
性質:クリーミーな白い結晶。溶解性;水(20℃) 1 g/l 、アルコール 20 g/l 。融点;200-202℃(分解)。Merck
Index 12 , 1469。UV; λ1 of max. ABS at pH 5.8 430-435 nm、λ2 of max. ABS at pH 7.6 615-618 nm。pK 7.0。
酸性では黄色で、中性領域(pH 6.0-7.6)で変色し、アルカリでは青くなる。
チモールブルー(pH 7.8 - 9.5 )と構造は似ていますが、チモール基に臭素(Br)が付いています。色の変わる構造の変化はチモールブルーと同じですが、変化はpH
6.0 - 7.6で起こります。やはり、臭素が付いたためフェノールのpKaが変わったためです。
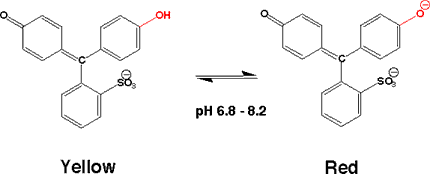
フェノールレッド(Phenol red)
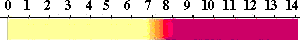
性質:ブラウンレッドの粉末。溶解性;水(20℃)0.8 g/l 、アルコール 4 g/l 。Merck Index
12 , 7397。UV; λ1 of max. ABS at pH 1.2 503-506 nm、λ2 of max. ABS at pH 3.0 430-435 nm、λ3 of max. ABS at pH
6.5 430-435 nm、λ4 of max. ABS at pH 8.0 557-560 nm。pK 7.9。
酸性から中性にかけて黄色ですが、pH 6.8から8.2で変色し、アルカリでは赤色になります。
酸性ではキノン型構造ですが、置換基が無いので長波長での吸収が無く黄色です。
アルカリでは、もう一方のフェノールがアニオンとなり、長波長に吸収があって赤色になります。
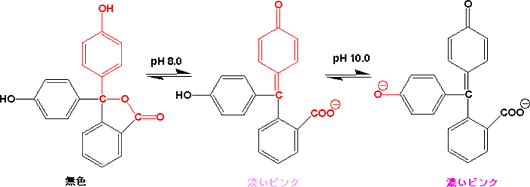
フェノールフタレイン(Phenolphthalein)
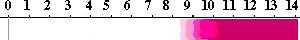
性質:小さな白い結晶。溶解性;水に不溶、アルコールに可溶。融点:258-263℃。Merck Index
12 , 7392。UV; λ of max. ABS at pH 9.8 551-554 nm。pKa 9.7。
中性では無色で、pH8以上では淡いピンクになるが、さらにアルカリになると強いピンクになります。
pH 8.0でラクトン環が開いて、1つのフェノールがキノン型になり、淡いピンクとなる。さらにアルカリ側でpH 10.0になると、もう一つのフェノールがアニオンとなって、濃いピンクとなります。
(指示薬の濃度が濃いと酸性で白濁します。また、アルカリの濃度が濃いpH >14では色が消えて透明になりますが、これは酸・塩基平衡反応ではなく、フェノールフタレインとアルカリの(OH-)が反応したためです。→補足説明)
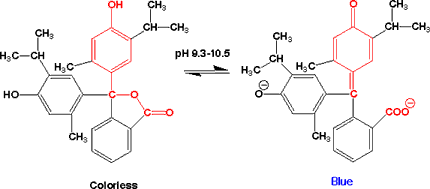
チモールフタレイン(Thymolphthalein)
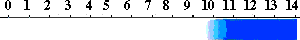
性質:白い粉末。溶解性;水(20℃)1 g/l 、アルコール 70 g/l 。融点:251-253 ℃。Merck
Index 12 , 9542。
チモールブルーとフェノールフタレインが一緒になったような構造です。pHによる構造の変化は、フェノールフタレインと同じです。pH
9.3 - 10.5で、無色から青になります。
アリザリンイエローR(Alizarin Yellow R )
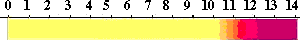
性質:ブラウンの粉末。溶解性;水に可溶 。Merck Index 12 , 251。UV; λ of max. ABS in NaOH
0.1 mol.l 490-496 nm。
ジアゾ基を含むメチルオレンジやメチルレッドと同じような構造です。
中性では黄色、アルカリ性(pH 10.1-12.1)では赤になります。
強いアルカリで変色する指示薬が少ないので、この指示薬が使われます。
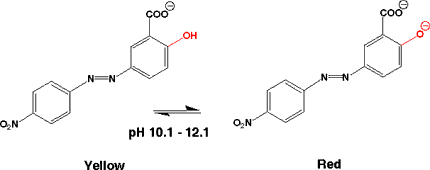
万能試験紙(universal indicator)
酸性からアルカリ性にかけてpHがわかる万能試験紙(広域試験紙)があり、溶液のpHを簡単に知ることができます。もちろん、1種類の指示薬に比べて精度は高くないですが、簡単さがいいですね。
これは、何種類かの指示薬を混合して、紙に吸収させたものです。たとえば、Thymol blue、Methyl red、Bromothymol blue、Phenolphthaleinなどをエタノールに溶かし、NaOHで中性にした液に浸します。
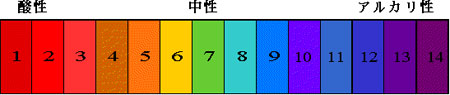
万能試験紙の変色は次のようになります。
 |
|
万能試験紙の色とpH
|
|