|
酸性(acid; acidic)、アルカリ性(alkaline; basic)とは水溶液の性質です。レモンのしぼり汁は酸性ですが、それはレモンに含まれるクエン酸(citric acid)のせいです。詳しい定義はあるのですが、このように水に溶かすと酸性を示すのが酸(acid)であると考えていいでしょう。強い酸は塩酸(HCl;
hydrochloric acid)で、pHは0です。石けん水は弱いアルカリ性ですが、それは脂肪酸のナトリウム塩のせいで、塩基(base)といいます。強いアルカリ性を示すのは苛性ソーダ(水酸化ナトリウム、NaOH;
sodium hydroxide)の水溶液で、pHは14です。水酸化ナトリウムは強い塩基です。このように、酸性と酸、アルカリ性と塩基は違うものですが、関係があります。
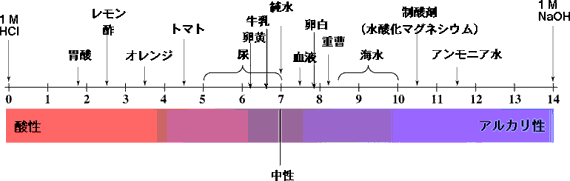
主な食品などのpHを次に示します。レモンやオレンジなどの酸っぱいものは酸性です。梅干しはレモンと同じクエン酸が入っていて酸性です。ミルクは中性に近いですが、卵の白身はアルカリ性です。よく間違えるのはアルカリ性食品です。これは食品を燃やした後の灰を水に溶かしたときのpHです。カルシウムやマグネシウムなどの金属を含む食品を燃やすと、金属は灰に含まれます。したがって、灰の水溶液はアルカリ性を示すのです。
 |
|
食品などのpH
|
酸と塩基を混ぜると、それぞれの性質がうち消し合ったものになりますが、これが中和(neutralization)です。酸とは酢酸(CH3COOH; acetic acid)やクエン酸などで、水に溶かすとプロトン(H+; proton)ができます。塩基とは苛性ソーダ(NaOH)やアンモニア(NH3)などで、水に溶かすとOH-(水酸化イオン、hydroxide ion)ができます。
酸と塩基を同じ量(等量)だけ加えた点を中和点(point of neutralization、または当量点)といいます。塩酸(HCl)を苛性ソーダで中和すると、水溶液は中性のpH
7になりますが、酢酸を苛性ソーダで中和すると、中性ではなくアルカリ性に偏ったpH 8.8になります。酸と塩基の強さに関係するのです。塩酸は強い酸ですが、酢酸は弱い酸だからです。
上の図で胃酸(胃液、gastric juice;胃酸、gastric acid)はpH 2付近ですが、胃酸が出過ぎると胸やけがします。これを抑えるのに制酸剤を飲みますが、水酸化マグネシウム(Mg(OH)2) で、そのpHは10.5です。制酸剤を飲むと、胃酸が中和されるのです。
酸が強いとか弱いとかとはどういうことなのかを考えてみます。HClを水に溶かすと、H2OにH+が付いたH3O+とCl-のイオンになります。HClはガス(塩化水素ガス、hydrogen chloride)で、これを水にとかしたものが塩酸です。
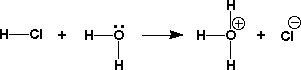
これを、簡単に次のように書きます。
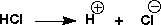
HClは水に入れると、イオンになったのです(解離といいます)。この反応は平衡(equilibrium)であって、その平衡定数(equilibrium
constants)は次のようになります。
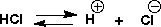
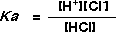
この平衡定数Kaを酸解離定数(acid dissociation constant)といいますが、pHと同じく対数の逆数をとって、一般にpKaで表し、酸の強さを示すことができます。塩酸は強い酸で、水中ではほとんどがイオンになっています。塩素イオン(Cl-)が安定なためです。塩酸では[HCl]が小さいのでKaは大きく、pKa
= -7です。
こんどは酢酸を水に溶かしてみます。やはり解離してイオンになりますが、塩酸のように全てがイオンにはなっていないのです。したがって酢酸の酸解離定数は小さく、平衡が全てイオンの方には行っていないのです。これは、CH3COOHは水の中でも安定で、CH3COO-になる必要がないのです。酢酸のpKa = 4.76です。

強い酸とは水の中でイオンになりやすく、同じ量を溶かしても多くのH+を出すものです。
苛性ソーダを水に溶かすと、塩酸と同じようにほとんどがNa+とOH-のイオンになります。苛性ソーダは強い塩基です。この場合の平衡定数を塩基解離定数とよび、やはりpKbで塩基の強さを表します。
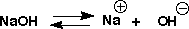
こんどはアンモニアを水に溶かしてみます。アンモニアはガスで、これを水に溶かしたものがアンモニア水です。苛性ソーダにはOHがありましたが、アンモニアにはOHがありません。しかし、水に溶かすと、NH3に水のH+が付いてNH4+になり、OH-が出てくるのです。しかし、NH3も安定で水にそのまま溶けるので、全てがイオンになっているわけではありません。アンモニアは弱い塩基なのです。アンモニア水を温めるとアンモニアガスが出てきます。アンモニアのpKb
= 4.76です。
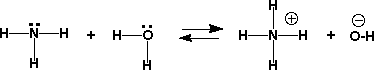
水はH+が取れてOH-になるので酸であり、またH+が付いてH3O+になるので塩基でもあるのです。
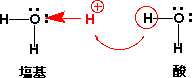
酢酸は水の中でH+を出すので酸ですが、酢酸イオン(CH3COO-)は水の中で次のような平衡になりOH-を出すので、塩基です。

塩酸水溶液に苛性ソーダ水溶液を加えていくと、溶液は酸性から中性、さらにアルカリ性になっていきます。塩酸が水酸化ナトリウムで中和されたのです。
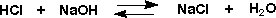
実際は水の中で解離した状態で進んでいるので、次のようにイオンが反応しているのです。中和とはNa+とCl-が等量になったことです。
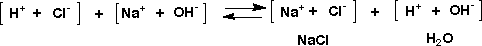
縦軸に溶液のpH(pHメーターで測定する)を、横軸に加えた苛性ソーダの量をとると図のような曲線がえられ、これが滴定曲線です。あるところでpHが急激に高くなりますが、そこが中和点で、塩酸と苛性ソーダ量が同じ(等量)になったところです。曲線に接線を引けば、接線の傾きが無限大になるところです。
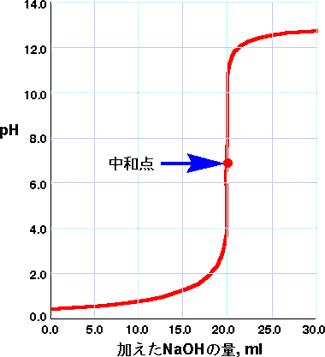
NaOHがゼロの点では、HCl水溶液のpH です。ほとんどがイオン化(H+ , Cl-)していますので、pHは0.0付近です。
NaOHを加えていっても、HClで中和されてしまうので、pHはそんなに高くなりません。この段階では、NaClが増加し、HClが減少しています。
この図ではNaOHを20ml加えたところでpHは急激に上がってきます。HClが無くなっていき、OHが増えていくためです。中和点はちょうど真ん中の点で、HClとNaOHの量が同じになり、HCl
やNaOH は無くNaClだけが存在します。
中和点を過ぎると、加えた NaOHが余ってきますので、溶液のpHは上がってきます。
このような中和滴定では、pHメーターを使わなくても指示薬(acid base indicator)を使えば簡単に行うことができます。指示薬は中和点付近で色が変化するものです。塩酸と苛性ソーダの中和では、リトマス試験紙やBTB指示薬が使えます(指示薬については次のQ&A で詳しく説明します)。
弱い酸である酢酸を強い塩基であるNaOH で中和すると酢酸ナトリウムができますが、中和点でのpHは7ではなくアルカリ性に偏った8.8ぐらいになります。そこで、この8.8に近いpKaをもった指示薬を使えばよいのです。たとえば、フェノールフタレインです。

CH3COOHとNaOHはそれぞれ水中で次のように解離していますが、CH3COOHの解離は弱いです。
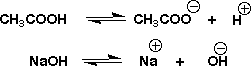
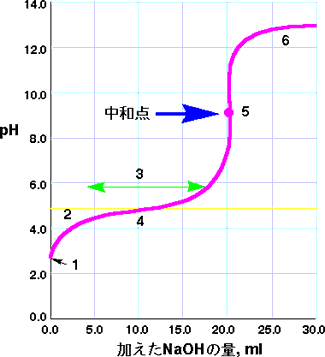
この場合の滴定曲線では、最初はゆっくりとpHが上がり、pH 8付近で急激に高くなります。
(1)HClの場合は、強い酸ですからほとんどイオン化していて、pHは0付近ですが、CH3COOHは弱い酸で全てがイオンになっていないので、pHは3付近です。
(2)加えたNaOHがCH3COOHに消費されればpHは変わらないはずですが、生成したCH3COO-がCH3COOHのイオン化を抑制するのでpHが少し上がります(共通イオン効果)。
(3)この領域ではNaOH を加えてもpHはほとんど変化がありません。これを緩衝液(buffer solution)といいます。緩衝液は液のpH
を一定に保ちたい時に使います。緩衝領域では次の式(Henderson-Hasselbalch 式)が成り立ちます。
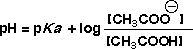
(4)CH3COOHが半分だけ中和された点(4)では、[CH3COO-]
= [CH3COOH]になるので、pH = pKa になります。すなわち、この点のpHはCH3COOHのpKaになるわけです。
(5)CH3COOHが全て中和された中和点です。CH3COOHはCH3COONa
になっています。この点のpHは中性の7ではなく、8.8ぐらいです。
(6)中和点を過ぎると、加えたNaOH が余ってくるので、溶液はアルカリ性になり、最後はpH 14になります。
次に、塩酸を苛性ソーダで中和するとpHは7になるのに、酢酸を苛性ソーダで中和するとpHは8.8になるのはなぜかを考えてみます。中和でできたものは酢酸ソーダ(CH3COONa)ですが、これを水に溶かしてみます。すると、次のようにイオンに解離します。
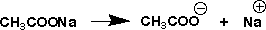
できた酢酸イオン(CH3COO-)は水の中で次のような平衡により一部酢酸になりH+が少なくなります。しかし、Na+は水の中で次のような平衡にありますが、Na+は安定でこの平衡はほとんど左に傾き、NaOHはできずOH-は無くなりません。
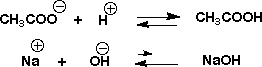
したがって、酢酸ソーダを水に溶かしても中性ではなくアルカリ性(pH 8.8)なのです。これは、酢酸を苛性ソーダで中和したときも同じで、中和点ではpH
8.8なのです。
せっけんは脂肪酸のナトリウム(またはカリウム)塩ですが、水に溶かすとアルカリ性になります。脂肪酸については豆腐のところで述べましたが、長い鎖の端に-COOHが付いたものです。したがって、せっけんを水に溶かすことは、酢酸ソーダを水に溶かしたのと同じです。アルカリ性は皮膚を痛めるので、注意が必要です。シャンプーの後でリンスをするのは、それを中和するためです。
|