|
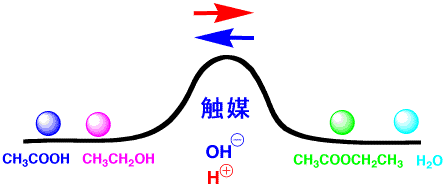
Q-35で、化学反応について説明しました。お酢の成分である酢酸(CH3COOH)と、お酒の成分であるエタノール(CH3CH2OH、アルコールの仲間)が化学反応すると、酢酸エチル(CH3COOCH2CH3)というエステルができました。その反応は、右にも左にも進行し、平衡反応でした。
 |
|
化学平衡
|
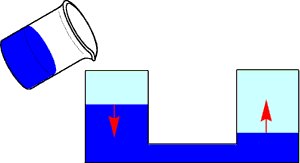
2つの水槽があり、下の方で連結されているものを考えます。最初は左の水が多いのですが、水が右に移って、そのうち同じ高さになります。そこで、左の水槽に水を注ぐと、左の水槽の水が多くなりますが、やはりそのうち右に移って同じ高さになります。もちろん、右に水を足せば、水は左に移動して同じ高さになります。
化学平衡とはこのようなもので、右と左の量が同じになることです。
 |
|
連結した2つの水槽
|
上の図では水の量(高さ)でしたが、化学平衡では物質の粒子(分子やイオン)の数が平衡に関係します。
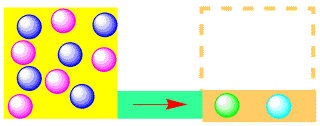
酢酸とエタノールから酢酸エチルができる場合、酢酸の分子(青い粒子)とエタノールの分子(赤い粒子)から、酢酸エチルの分子(緑の粒子)と水の分子(空色の粒子)ができます。最初は左側の粒子の数が多く、右側の粒子が少ないので、反応は右に進んで、緑と空色の粒子ができます。
 |
|
(1)酢酸とエタノールの化学反応
|
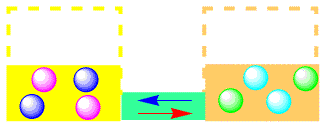
ある程度反応が進むと、左側の粒子が減って、右側の粒子が増え、そのうち同じ数になります。この時には、右向きの反応と左向きの反応の速さが同じになります。もし、右向きの反応が左向きの反応よりも速ければ、こんどは右側の粒子の数が増え、反応は左に進むようになるからです。このような、右向きと左向きの反応の速さが同じになることを、平衡(equilibrium)といいます。
右と左の高さが同じなので、見た目には何の変化も無いように見えますが、右に行ったり左に行ったりと、激しく移動しているのです。
 |
|
(2)平衡になった反応
|
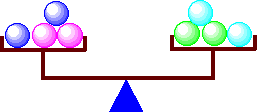
これは、上皿てんびんで考えてもいいですね。てんびんの右と左に同じ数だけ載せれば、バランスがとれますが、片方が少ないと傾いてしまいます。
 |
 |
|
てんびんのバランス
|
上皿てんびん
|
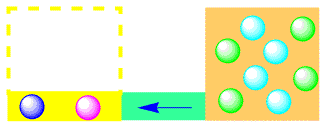
最初に右側に酢酸エチルと水があれば、反応は左に進み、酢酸とエタノールができ(加水分解)、そのうち右向きと左向きの速度が同じになって平衡になります。
 |
|
(3)加水分解反応
|
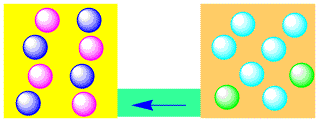
今度は、上の(1)の段階で、右側に水(空色の粒子)を入れてみます。すると、粒子の種類(色)は違いますが、数は同じになるので、反応は右には進まなくなります。
家庭で使うお酢やお酒には水がたくさん入っています。したがって、お酢とお酒を混ぜても酢酸エチルはできないのです。逆に、酢酸エチルとともにできる水を取ってやれば、反応は右側にどんどん進み、酢酸エチルが100%できることになります。
 |
|
(4)水が多い場合の平衡
|
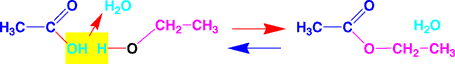
平衡反応を化学式で書けば、次のようになります。左側は左の水槽、右側は右の水槽と考えてください。平衡では、右向きの赤い矢印と、左向きの青い矢印の大きさが同じになっています。
 |
|
平衡反応の化学式
|
右に進む(赤い矢印)の速度を考えてみます。右に進む速度(Vr)は、酢酸の数[CH3COOH]とエタノールの数[CH3CH2OH]に比例しますので式(1)のようになります。ここで、krは比例定数で、速度定数といいます。左向きの速度(青い矢印)も、同様に式(2)のようになります。
平衡では赤と青の速さが同じなので(Vr = Vb)、式(3)になります。これから、式(4)が得られます。ここで、kb /
kr をKとして、平衡定数といいます。平衡定数とは速度定数の比になります。ただし、K はkr / kbではなくkb
/ krになっていますので、逆数です。
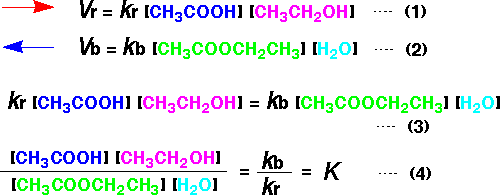 |
|
速度、速度定数、平衡定数
|
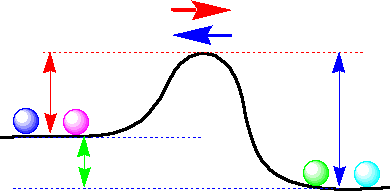
一番上の平衡の図(1)では、簡単のため右側と左側の高さを同じにしましたが、実は高さが違うのです。もし右側が安定であれば底が低くなりますので、右に進む山の高さ(赤い矢印)よりも左に進む山の高さ(青い矢印)の方が高くなります。この場合は、右に進む速度の方が、左に進む速度よりも速くなります。速度定数(kr,
kb)は山の高さを表しているのです。もっとも、山が高くなると速度定数が小さくなるので、反比例の関係になりますが。
 |
|
右側が安定な反応の例
|
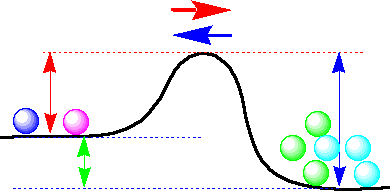
上の図の例では、青の速度定数(kb)<赤の速度定数(kr)なので、速度を同じ(平衡)にするためには緑と空色の粒子を増やす必要があります。式(2)を見ると、速度定数(kb)が小さいので、速度(Vb)を同じ大きさにするには、粒子の数を増やす必要があるのです。
 |
|
平衡にするには右側に粒子を増やす
|
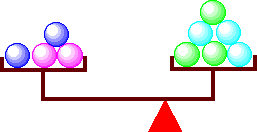
この例をてんびんで考えると、支柱を右にずらしたことになります。バランスをとるためには、右側の皿に多く載せる必要があります。
|
|
|
てんびんの支柱が右に寄った例
|
|