|
 銀のスプーンとさびたスプーン 銀のスプーンとさびたスプーン
銀の錆(さび)
「錆」の定義が難しく、鉄の酸化物に付けられた「腐食生成物」のことのようです。
銀の場合、白い酸化銀はあるのですが、鉄のように空気中の酸素で酸化物ができることはなく、酸化銀は銀イオン(Ag+)を含む水溶液に苛性ソーダ(NaOH)のような水酸化物イオン(OH-)を含む物質を加えると白い酸化銀(Ag2O)が生成し沈殿します。
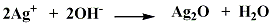
この酸化銀は空気中で加熱すると銀と酸素に分解します。
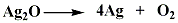
それでは、銀の表面が黒くなるのはなぜでしょう。
じつは、あの黒いものは硫化銀なのです。空気中に存在する硫化水素(H2S)と反応してできたものです。硫化水素は卵の腐ったような臭いがするガスで、火山や温泉から出ています。また、石油には硫黄が含まれていて、その燃焼で発生しますので、工場の排ガスや自動車の排ガスにも含まれています。現在は排ガスの対策ができていますので多くはないですが、それでも含まれています。銀のスプーンが黒くなったのは、空気中に存在する微量の硫化水素のせいです。
硫化銀
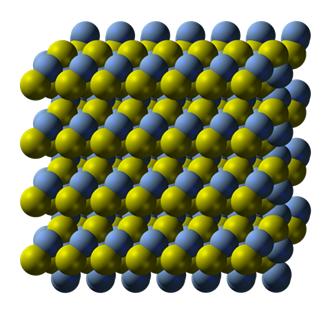
硫化銀(Ag2S)の構造は研究されていて(Mineral J. (1967). 5, 124-143)、図のような構造であることが明らかになっています。この構造を見ると、-Ag-Ag-Ag-の結合があり、金属銀の一部とみなせます(黄色が硫黄、青が銀)。また、Ag-Sの結合は共有結合だと言われています。
 |
|
硫化銀の結晶構造
|
硫化銀はなぜ黒いか?
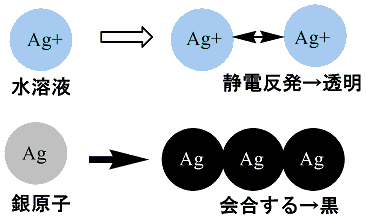
硫化銀が黒い理由については詳細な研究は見られず、以下は筆者の推測で証拠はありません。銀イオン(Ag+)は無色で、例えば硝酸銀溶液が透明なので理解できます。しかし、硝酸銀溶液に光が当たると還元されてイオンではないAgになり黒くなります。写真のネガの黒です。Ag+はイオンですので、静電反発によりAg+は会合することはありませんが、還元によりAgになるとAg原子は会合し金属銀のようになります。金属銀はすべての波長の光を吸収するので黒くなります。
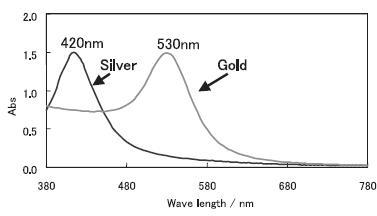
金属の銀は光を通さないので吸収スペクトルを測定することはできませんが、最近、見た目は透明な銀のナノ粒子が作られ、そのスペクトルが報告されています。
次の図は、小林敏勝、 表面科学、Vol. 26, No.2, pp. 107-111, 2005から引用いたしました。
金と銀ナノ粒子の吸収スペクトル
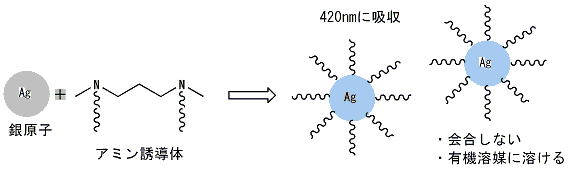
もう一つ銀の粒子を会合させなくする方法は、銀粒子の表面をアルキルメルカプタンで反応させ、銀粒子の表面をアルキル基で覆う方法です。このような粒子は有機溶媒に溶けますので、吸収スペクトルを測定することができます。これは、ちょうど銀が石鹸で覆われたようなものです。
このようなナノ粒子が大きくなると、上のスペクトルでのすそ野の吸収が大きくなり黒くなってきます。これらの事から推測すると、銀粒子は420nmに吸収があるものですが、会合により粒子が大きくなると、黒くなってきます。これは、Ag-Ag-Agによる金属の吸収によるものと思われる。
銀の性質
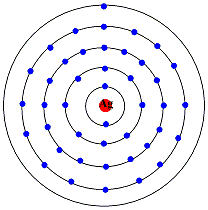
銀原子の電子配置から、銀の性質を見てみましょう。銀は原子番号47の貴金属で、銅や金と同じ11族の元素で、電子配置は[Kr]4d10
5s1です。[Kr]は、電子が充満したクリプトンの電子配置です。
|

|
|
 |
|
銀コイン
|
|
Agの電子配置
|
電子は内殻のd軌道を埋めていき、内殻があと1つで安定な(d軌道が満員になる)状態なので、1つ外側のs 軌道の1つの電子(5S1)を借りてきて内殻のd軌道が埋まります(4d10)。最外殻のs軌道は電子は1つになるためイオンは1価になります。銅に比べて銀は原子番号が大きいので、d軌道以外にf軌道などもあり、外側に電子が出にくく1価が安定になります。
銀の黒いさびを取る方法
銀製品の黒いさびをとる方法は、鍋に水を張り、食塩や重曹を入れ、黒くなった銀食器をアルミフォイルで包み入れ、10分ほど加熱すれば、元のきれいな銀食器になります。これはアルミニウムがマイナス極、さびた銀がプラス極の電池ができ、そのときに硫黄が抜けるためです。食塩や重曹を入れるのは、純水では電気が流れないので、電気が流れるようにするためです。

この方法は、硫化銀を銀に戻す化学反応(電気化学反応)を利用したわけです。アルミニウムがマイナス極、黒い銀がプラス極となり、電池ができるのです。アルミニウムがイオンになって硫黄を硫化銀から抜いて硫化アルミになり、黒い銀食器から銀がイオンになって銀に戻るのです。
では、どうしてアルミニウムを使うといいのでしょう。アルミニウムと銀を比べると、アルミニウムの方がイオン化傾向(ionization
tendency)が大きいためです。
イオン化傾向
金属は電解質の水溶液に溶け出すと陽イオンとなります。種類によってイオンになりやすいもの、なりにくいものがあり、その順番はイオン化傾向と呼ばれます。
金属をイオンになりやすい順番にならべてみます。
イオンになりやすい←: イオンになりにくい→
K>Ca>Na>Mg>Al>Zn>Fe>Ni>Sn>Pb>[H]>Cu>Hg>Ag>Pt>Au
この順番は、電池をつくるときどちらが−極になるか判断でき、左にあるほうが−極、右にあるほうが+極となります。水素は金属ではありませんが陽イオンになるので、基準になります。イオン化傾向の小さい、金・白金・銀は錆びないと言われています。
銀とアルミニウムがあると、アルミニウムよりも銀の方がイオンになりやすく溶けやすいのです。したがって、アルミニウムの存在で硫化銀があると、銀がイオンになり、アルミニウムは硫化アルミニウムになり、銀の輝きが取り戻すことができるのです。
ダニエル電池
イオン化傾向の違いを利用すると電池ができます。1836年にイギリスのダニエル(Daniell, John Frederic)は,ダニエル電池と呼ばれる電池を発明しました。これは,素焼きで区切った容器の片側に薄い硫酸亜鉛水溶液を,他方に濃い硫酸銅(II)水溶液を入れ,それぞれの液に亜鉛板と銅板を入れたものです。素焼きのしきりは,液体は混ざりませんが、イオンは通過します。
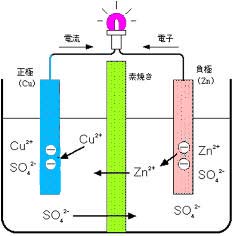
この電池は銅板が正極,亜鉛板が負極になり,両極を導線でつなぐと銅から亜鉛に電流が流れます。亜鉛から銅に電子が移動して,亜鉛が溶けて滅っていきます。また、銅板上には銅が析出してきます。
正極 Cu2++2e-→ Cu 負極 Zn → Zn2++2e-
銀イオンの性質
光反応
銀は写真の感光剤(臭化銀AgBr、ヨウ化銀AgIなど)として利用されています(Q&A 23)。銀のハロゲン化物が光を受けて銀原子を遊離すること(潜像)を利用し、適当な還元剤と反応させることによりその変化を増幅し(現像)、画像を記録することが可能です。さらに、単独では濃淡しか表現できませんが、複数の色素とフィルタ等を組み合わせ、波長に応じて感光の度合いを変化させることにより、カラーでの記録も可能になります。
銀イオンの抗菌性
銀をはじめ、多くの金属イオンには抗菌性があります。水銀(Hg)、カドミウム(Cd)などの重金属は安全性に問題があるので、使用できるのは銀、銅、亜鉛ぐらいです。
抗菌性と殺菌性とは異なります。殺菌とは菌を殺すことで、たとえば加熱することにより菌は死んでしまいます。菌はどんどん増えていきますが、これを抑えると、菌が増えることはありません。食品を冷蔵庫に入れておけば、菌の増殖を抑えることができます。
バイ菌やウイルスの表面はマイナスの荷電を持っています。これは、表面がリン酸エステルを含んでいるからです。プラス荷電を持った金属イオンがあると、バイ菌がこのプラス荷電に集まり、菌が動けなくなり、増殖が抑えられます。
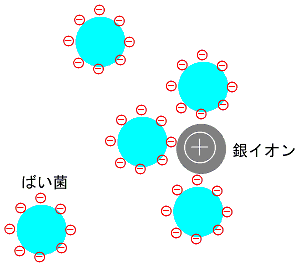
銀イオンによるばい菌の吸着イメージ
銀イオンの殺菌作用についての研究(椿井靖雄:多様化する無機系抗菌剤と高度利用技術,アイピーシー,25-68(1997))から殺菌速度はハロゲンイオンの種類には関係なく、銀の濃度で決まることが明らかにされています。
バイキンの表面は、リン酸エステルとタンパク質からできています。タンパク質はアミノ酸からできていますが、そのアミノ酸成分と銀イオンとの反応も重要です。 銀イオンの抗菌機能を発揮する本質は、銀イオンAg+と-SH基(スルフヒドリル基)との反応であるらしいということがわかってきました。
銀イオンは-SH基を有するアミノ酸であるシステイン(HS-CH2-CH(-NH2)-COOH)と強く結合します。
その他、同様にグルタチオン(-SH基を有するトリペプチド)もシステインと同様強く結合します。
竹の皮とわさび
竹の皮やワサビにも抗菌性があると言われていますが、銀イオンと同じでしょうか。
ワサビの辛味成分は、芥子菜など、アブラナ科の植物が多く含むからし油配糖体(グルコシノレート)の一種のシニグリンが、すりおろされる過程で酸素に触れ、細胞にある酵素と反応することにより生成されるアリルイソチオシアネートであり、殺菌効果もあります。
人工的にはチオシアン酸カリウムとヨウ化アリルから合成します。水にはほとんど溶けず、有機溶媒に溶けます。
KSCN + H2C=CH-CH2-I → H2C=CH-CH2-N=C=S + KI
非常に活性な化合物で、菌などと反応するものと思われます。わさびは寿司や刺身などに使われますが、生魚に付着する菌を殺菌する効果があるのです。
しょうがには、殺菌力のある、からみの成分シンゲロンが含まれています。寿司屋で出るガリ(生姜)は、単に箸休めのためではありません。
昔から食品を包むのに使われている竹の皮にも殺菌成分が含まれると言われています。
|