 フルオレセインの実験をしたのですが、フルオレセイン溶液を作ったときは普通の黄色で、アルカリ性にしたときに色が褐色になって緑の蛍光が発生しました。どうしてアルカリ性にしなければいけないんですか? フルオレセインの実験をしたのですが、フルオレセイン溶液を作ったときは普通の黄色で、アルカリ性にしたときに色が褐色になって緑の蛍光が発生しました。どうしてアルカリ性にしなければいけないんですか? |
 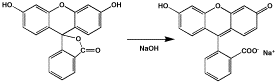 フルオレセインは環状(ラクトン環)になっていて、黄色で蛍光は少ないです。 フルオレセインは環状(ラクトン環)になっていて、黄色で蛍光は少ないです。
中性になると環は開くのですが、赤くなってやはり蛍光はありません。
蛍光が強いのは、アルカリを加えて、図の右側のようになったときです。この時は、分子の上側の6角が3つ並んだものが平面で共役していますので、エネルギーが回転などにより逃げることがなく、エネルギーが蛍光として発します。 |
| |
 「0.1%ルミノール溶液と10%水酸化ナトリウム水溶液に15%過酸化水素水を10:1で混合する」との記載がありますが、この反応は暗室など、暗いところで検出可能でしょうか。 「0.1%ルミノール溶液と10%水酸化ナトリウム水溶液に15%過酸化水素水を10:1で混合する」との記載がありますが、この反応は暗室など、暗いところで検出可能でしょうか。
460 nmの蛍光と記載されておりますので目視で見えそうですが、 |
 450 nmの蛍光を発しますので、目視で見えます。 450 nmの蛍光を発しますので、目視で見えます。
蛍光はそんなに強くないので、暗いところの方がよく見えます。 |
| |
 ルミノール反応で、「液をかけてランプで照らすと」との記載のように、なにか励起装置が必要となるのでしょうか。 ルミノール反応で、「液をかけてランプで照らすと」との記載のように、なにか励起装置が必要となるのでしょうか。 |
 反応が起これば蛍光が出るのですが、見落としてしまいます。そこで、基底状態に落ちた3−アミノフタル酸に紫外線を当てると、蛍光を発するので見えます。 反応が起これば蛍光が出るのですが、見落としてしまいます。そこで、基底状態に落ちた3−アミノフタル酸に紫外線を当てると、蛍光を発するので見えます。
当てる光は紫外線で、ブラックライトとかいうものが市販されています。薄層クロマトグラフィーでも検出に使う物です。 |
| |
 ルミノール反応で、水酸化ナトリウムのかわりに炭酸ナトリウムや炭酸カリウムを使用する例もあるようですが、これはルミノールを溶解させる為に加えるのでしょうか。 ルミノール反応で、水酸化ナトリウムのかわりに炭酸ナトリウムや炭酸カリウムを使用する例もあるようですが、これはルミノールを溶解させる為に加えるのでしょうか。
pHによって発光の強さに差が出るとも聞いたのですが、実際の血液に使用する場合に適し
た濃度というのはあるのでしょうか。 |
 炭酸ナトリウムや炭酸カリウムは水酸化ナトリウムに比べて弱いので、だめだと思います。3−アミノフタル酸のカルボン酸が2つともマイナスになる必要があるので、強いアルカリが必要です。ルミノールを溶かすためではありません。 炭酸ナトリウムや炭酸カリウムは水酸化ナトリウムに比べて弱いので、だめだと思います。3−アミノフタル酸のカルボン酸が2つともマイナスになる必要があるので、強いアルカリが必要です。ルミノールを溶かすためではありません。
かける液があまり少ないとだめですが、試されるのが一番いいです。 |
| |
 同じ波長の光を当てて,蛍光を発する物質Aと吸収する物質Bが混ざっている溶液の蛍光度を分光蛍光度計で測定したいと考えています.この場合の蛍光度は,Aの濃度が同じでも,Aを単品で測定した場合に比べて見かけ上,低くなると考えてよいでしょうか. 同じ波長の光を当てて,蛍光を発する物質Aと吸収する物質Bが混ざっている溶液の蛍光度を分光蛍光度計で測定したいと考えています.この場合の蛍光度は,Aの濃度が同じでも,Aを単品で測定した場合に比べて見かけ上,低くなると考えてよいでしょうか. |
 光の強さが強い場合と弱い場合によって異なります。 光の強さが強い場合と弱い場合によって異なります。
(1)光の強さが弱い場合(100と仮定します)
Aだけの場合Aが100吸収し、10の蛍光を出します(蛍光の量子収率が10(%)と仮定します)。これにBを加えると、Aが60吸収し、Bが40吸収します(その波長での吸光係数が60:40と仮定します)。したがって、Aからの蛍光は、60X0.1=6になり、低くなります。
(2)光の強さが非常に強いとき(1000と仮定します)
Aは100吸収し、そのほか(900)は透過して出てしまいますので、蛍光は10です。これにBを加えますと、Aは100吸収し、Bは66[100x(2/3)=66.666]吸収し、その他は透過します。蛍光は10です。光が強いと、Bが吸収しても、十分残っているからです。
光が十分強いかどうかを見るには、透過する光の強さを測定すれば良いでしょう。または、光の強さを変化させて蛍光を測定し、Aの蛍光がだんだん10に近づく光の強さを求めればよいでしょう。 |
| |
 アルブミンなどの生体試料を蛍光光度計で測定すると、蛍光度が時間と共に少しずつ下がっていくのですが、どういう理由が考えられるでしょうか。また、基本的に蛍光度の最適測定時間といったものはあるのでしょうか。 アルブミンなどの生体試料を蛍光光度計で測定すると、蛍光度が時間と共に少しずつ下がっていくのですが、どういう理由が考えられるでしょうか。また、基本的に蛍光度の最適測定時間といったものはあるのでしょうか。 |
 もう一度測定したときに、再び同じ値になるかによって理由が異なります。 もう一度測定したときに、再び同じ値になるかによって理由が異なります。
たとえば、最初100で、時間とともに減少して50になったとします。
(1)もう一度測定したとき、50のままでしたら、アルブミンが光反応をしたと考えられます。それは、光化学反応による分解と、アルブミンのコンフォメーションが変化して構造が変化したか、凝集などが起こったと考えられます。常に新鮮なサンプルで測定する必要があります。低温で測定すればいいかもしれません。いずれにしても、生体試料ですので迅速に測定する必要はあります。
(2)もし、もう一度測定して、100に戻っていたとします。この場合は、励起状態の物が増えて、もはや基底状態から励起状態に上がらない状態になっていたと考えられます。
おそらく(1)が理由だと思います。 |